重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为
03,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:
请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是 。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如下图所示。
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液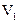 mL,使水中的还原性物质完全被氧化(还原产物为
mL,使水中的还原性物质完全被氧化(还原产物为 );再用
);再用
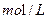 的FeS04溶液滴定剩余的
的FeS04溶液滴定剩余的 ,结果消耗FeS04溶液
,结果消耗FeS04溶液 mL。则该水
mL。则该水
样的COD为  。
。
电解原理在化学工业中有广泛的应用。如下图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连。
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,试判断:
①a是________极(填“正”或“负”),B是________极(填“阴”或“阳”);
②A电极上的电极反应式为
________________________________________________________________________,
B电极上的电极反应式为
________________________________________________________________________;
③检验A电极产物的方法是
________________________________________________________________________
________________________________________________________________________。
(2)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则
①A电极的材料是________,电极反应式为
________________________________________________________________________
______________;
②B电极的材料是________,电极反应式为
________________________________________________________________________
______________。
(3)用惰性电极电解CuSO4溶液。若阴极上析出Cu的质量为3.2 g,则阳极上产生的气体在标准状况下的体积为________;常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为________。
按如图所示装置进行电解,在通电一段时间后,铁电极的质量增加。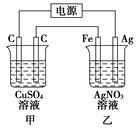
(1)乙杯中,两极发生的电极反应式是
________________________________________________________________________
________________________________________________________________________。
(2)甲杯中发生反应的化学方程式是
________________________________________________________________________
________________________________________________________________________。
(3)C—C—Fe—Ag四个电极上析出或溶解物质的物质的量比是________。
普通泡沫灭火器内的玻璃筒里盛Al2(SO4)3溶液,铁筒中盛NaHCO3溶液,其反应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
不能把Al2(SO4)3溶液盛在铁筒中的原因是
________________________________________________________________________
________________________________________________________________________。
不用溶解度较大的Na2CO3代替NaHCO3的原因是
________________________________________________________________________。
水解反应是广泛存在的一类反应,盐的水解即为一例。越弱越水解是盐水解的重要规律,如NaCl不水解,MgCl2水解,而同浓度的AlCl3水解程度比MgCl2高。从同周期中元素金属性递变规律看H4SiO4的酸性更弱,因而SiCl4水解更完全。
(1)请写出下列化学方程式:
①SiCl4水解:
________________________________________________________________________;
②PCl5水解:
________________________________________________________________________。
(2)Mg3N2及CaC2与水反应也可看做水解,注意以下规律:
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
CaC2+2H2O===Ca(OH)2+C2H2↑
写出下列化学方程式:
①Ca3P2与水反应:
________________________________________________________________________;
②Mg3C2与水反应:
________________________________________________________________________。
已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号字母),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
(3)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”、“减小”或“不变”)(已知25 ℃ 时,CH3COONH4溶液呈中性)。
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液。判断:
①溶液中共有________种粒子。
②溶液中有两种粒子的物质的量的和一定等于0.010 mol,它们是________和________。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol。