某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: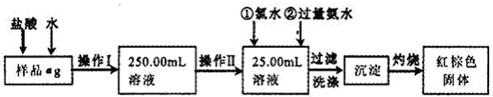
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
| A.50mL烧杯 | B.50mL量筒 |
C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
(11分)三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵(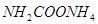 ),其反应化学方程式:
),其反应化学方程式:
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取 ,该实验利用干冰升华产生
,该实验利用干冰升华产生 气体的有优点有_____.
气体的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素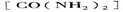 _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
_______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
【改编】(15分)一种广泛用作药剂、有机氯化剂,及用于制造染料、橡胶的化工原料——硫酰氯(SO2Cl2),常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3kJ·mol-1
SO2Cl2(l) △H=-97.3kJ·mol-1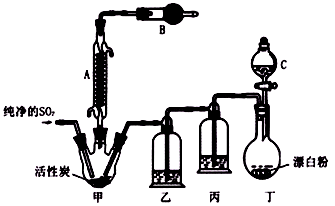
(1)仪器A的名称是 ;甲中活性炭的作用是__ ____。
(2)干燥管B中盛放的药品是 。
(3)实验时从仪器C中放出液体的操作方法是 。
(4)装置乙中盛放的物质为 ,若缺少装置乙,对实验结果有什么影响? 。
(5)氯磺酸(ClSO3H)是一种无色的发烟液体,有刺激性臭味,沸点178℃,受热分解也能制得硫酰氯, 同时还有另外一种物质生成,该反应的化学方程式为 ,分离的产物的方法是 。
A.重结晶B.过滤 C.蒸馏D.萃取
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 (填序号)。
A.控制气流速度,宜慢不宜快
B.水浴加热三颈烧瓶
C.若三颈烧瓶发烫,可适当降温
(15分)氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K;
(2)废铁屑中的杂质不与盐酸反应;
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
20 |
80 |
100 |
| 溶解度(g/100 g H2O) |
74.4 |
91.8 |
525.8 |
535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.……,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 后、 _ 、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2 + 2S2O32- ═ 2I- + S4O62-)。
①滴定终点的现象是 _ 。
②样品中氯化铁的质量分数 _ 。
【原创】(15分)二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下:
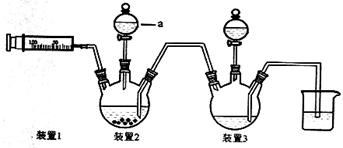
相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑
[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
【命题立意】本题基于实验室制备二氯化一氯五氨合钴,融入工艺流程、实验原理分析、实验基本操作、条件控制、产率计算等内容,旨在考查考生知识迁移能力、综合实验能力和实验探究能力。
【改编】(15分)硫代硫酸钠俗称“海波”,又名“大苏打”,具有较强的还原性和配位能力,是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式 。装置B、D的作用是 。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是 。
步骤4:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42—全部转化为Cr2O72—;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L—1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:
①Cr2O72— + 6I—+ 14H+ ="=" 2Cr3+ + 3I2 + 7H2O;
②I2 + 2S2O32— ="=" 2I—+ S4O62—
则该废水中Ba2+的物质的量浓度为 。