下列说法错误的是
| A.油脂、淀粉和蛋白质都是高分子化合物,它们在一定条件下都能水解 |
| B.植物及其废弃物可制成乙醇燃料,它是一种可再生能源 |
| C.含3个碳原子的有机物,每个分子中最多可形成3个C-C单键 |
| D.石油的分馏是物理变化;石油的裂化和裂解以及煤的干馏都是化学变化 |
下列对化学平衡移动的分析中,不正确的是()
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
在密闭容器中发生下列反应aA(g)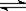 cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.平衡向正反应方向移动 | B.A的转化率变大 |
| C.C的体积分数变大 | D.a < c+d |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
提示:BaSO4(s) Ba2+(aq)+SO(aq)的平衡常数KSP=c(Ba2+)·c(SO ),称为溶度积常数。
Ba2+(aq)+SO(aq)的平衡常数KSP=c(Ba2+)·c(SO ),称为溶度积常数。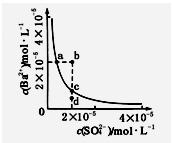
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的KSP大于c点对应的KSP |
可逆反应: 2NO2(g ) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ |
| C.①③④⑤ | D.全部 |