下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。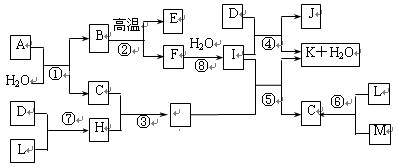
请回答下列问题:
(1)物质E的结构式为 __________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
______________。
(5)在一定温度下,有甲、乙 两容积相等的密闭容器。
两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度 ②适当增大压强
③不断分离出产物C ④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,
则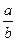 ________
________ 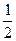 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题: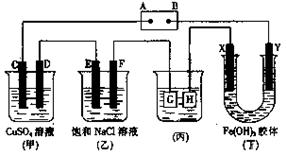
(1)电源A极的名称是。
(2)甲装置中电解反应的总化学方程式是_________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: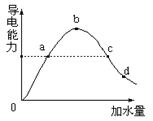
(1)加水前导电能力为零的理由是:
(2)a、b、c、d四点醋酸的电离度大小顺序是
(3)a、b、c、d四点溶液PH值大小顺序是
(4)若要把b点溶液中(CH3COO-)、(OH-)均减小,可采用的方法是 (选择正确的选项)
| A.加水 | B.加NaOH | C.加H2SO4 | D.加Na2CO3 |
(4分)已知HCO3—比HBrO更难电离,但HBrO的酸性比H2CO3弱,写出以下反应的离子方程式:
(1)向NaHCO3溶液中滴加少量溴水:
(2)向Na2CO3溶液中滴加少量溴水:
已知元素的电负性和原子半径等内容一样,也是元素的一种基本性质。下面给出14种元素的电负性:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0. 9 9 |
3.5 |
2.1 |
2.5 |
1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是____▲___;
(2)根据你的理解,元素的电负性指_____▲__ ;
(3)预测Br和I元素电负性的大小关系▲。
有A、B、C、D四种元素,其原子序数大小关系为A>B>C>D。已知:将0.5 mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子。当A的单 质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
(1)元素符号:A___▲__,B___▲__,C__▲___,D__▲__。
(2)鉴定某物质中含有B元素的最简单的实验是__▲__。
(3)A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是(用化学式表示)__▲____。