实验室中有甲、乙、丙三位学生做制备氢氧化铝实验,桌上放着同样的药品:231g浓度为70%的硫酸,含杂质苛性钾20%的烧碱140g及足量的铝屑,三位学生分别制得氢氧化铝w1g,w2g,w3g,实验的三种方案示意图如下:
(1)从充分利用原料,降低成本和提高产率等因素分析,哪个学生实验方案最佳(用甲、乙、丙序号表示)__ _____。
(2)三位学生分别制得氢氧化铝质量大小的顺序为(用w1,w2,w3序号表示):___ ____。
煤的气化是高效、清洁地利用煤炭的重要途径之一。
(1)在250C 101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为
___________
又知: ①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+ O2(g)═CO2(g)△H=-283.0kJ/mol
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g) △H=____kJ/mol
(2) CO可以与H2O(g)进一步发生反应: CO(g)+H2O(g) CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
(3) 工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应反应N2(g)+3H2(g 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为________;
②由第一次平衡到第二次平衡,平衡移动的方向是________,采取的措施是________。
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2________T3填“〉、=、<”判断的理由是________________。
已知:当羟基与双键碳原子相连接时,易发生如下转化: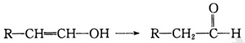 化学式为C11H10O4的有机物A有如下的转化关系
化学式为C11H10O4的有机物A有如下的转化关系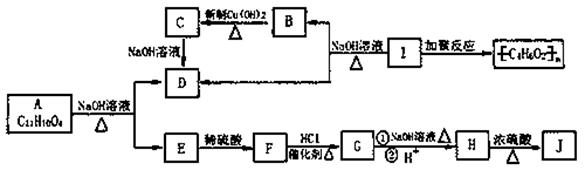
其中F为苯的二元对位取代物,分子中含有羟基、羧基及碳碳双键,存在顺反异构现象,J分子中有三十六元环状结构,其中一个六元环含有两个酯基。试回答:
(1)写出有机物结构简式:I:____,J:
(2)指出F→G的反应类型:
(3)写出A→E+D 的化学反应方程式:
(4)写出G与NaOH溶液共热的化学反应方程式:
(5)F的同分异构体F1也为苯的二元对位取代物,且与F具有相同的官能团,但其不存在顺反异构现象,则F1的结构简式为。
已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| A |
原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B |
原子核外M层电子数是N层电子数的4倍 |
| C |
是使用最为广泛的合金的主要成分 |
| D |
原子各内层电子均已饱和,最外层电子数为1 |
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____,D元素原子的外围电子排布式为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____
a:CO2b:SO2 c:NH3d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____,与B离子最近且等距的A离子的个数为。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___ _(可用根号表示)。
下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,利用2Na2S2+NaBr3 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
(1)当蓄电池工作放电时,电池中Na+的移动方向是:____(填“电极a→b”或“电极b→a”),电极a的电极名称为,发生的电极反应为。
(2)当蓄电池处于充电状态时,电极a应接外电源极(填“正”或“负”),电极b的电极名称为,发生的电极反应为。
(3)若左侧储罐的中溶液体积为VL(导管、泵及电池内部溶液忽略不计),一段时间观察,溶液中Na+的平均浓度由c1mol·L-1降至c2mol·L-1,则此装置该段时间正处于(填“放电”或“充电”)状态,此过程中电极b上转移电子的物质的量共有__mol。
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g) CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
(1)已知:① CH4(g)+3/2 O2(g) CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g) H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g) CO(g)+3H2(g)的△H=____(用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____(用含△H1,△H2的式子表示)
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____KB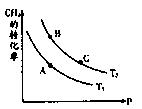
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____。