(6分) 某同学进行如下实验,探究化学反应中的能量变化。
通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低。由此判断NaOH溶液跟盐酸的反应是 (填 “吸热”或“放热”)反应,Ba(OH)2· 8H2O跟NH4Cl的反应是 (填“吸热”或“放热”)反应。反应①中反应物的总能量 填(“大于”、“小于”或“等于”)生成物的总能量。反应②中断开反应物中的化学键所吸收的能量 填(“大于”、“小于”或“等于”)形成生成物中的化学键所放出的能量。
(4分)A、B、C、D四种气体,都是大气的污染物。国家环境保护法严格禁止把这类气体大量排入空气中,工业上通常都用碱液加以吸收。已知A的水溶液是一种无氧酸,A在空气中充分燃烧得到B;B是形成酸雨的主要污染物;C是一种单质,其水溶液具有漂白作用;D是硝酸工业尾气中有害物质之一,易溶于水。根据推断结果和下列要求写出有关的化学方程式。
(1) A在空气中完全燃烧:。
(2) B的水溶液被空气氧化:。
(3) C跟消石灰反应:。
(4) D跟水反应:。
(10分)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。用微粒符号完成下列问题:
(1)Y、Z两种元素的最高价氧化物的水化物酸性___________强于___________。
(2)M、Z、Y形成的简单离子的半径的大小________________。
(3)M2X2固体中阴、阳离子个数比____________,其电子式为_______________。该物质中含有化学键的类型有______________和______________。
(4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为____________。
(10分)在短周期元素中:①金属性最强的元素是______,与水反应最剧烈的非金属是_____;②地壳中含量最丰富的元素位于第________周期第________族,地壳中含量最多的金属元素位于周期表的第________周期第________族.
在11~18号的元素中,③原子半径最小的元素是________,阳离子半径最小的是________,阴离子半径最小的是________,④元素最高价氧化物中既能与盐酸反应又能与烧碱反应,该氧化物是________.
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有6个电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性. |
| Z |
元素最高正价是+7价 |
(1)元素T为元素(填元素名称)。元素X的一种核素可测定文物年代,这种核素的符号是。
(2)元素Y在周期表中的位置。
(3)元素Z的原子结构示意图为。
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),能证明这一事实的依据是。
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是(填酸的化学式),理由是。
(6分)将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。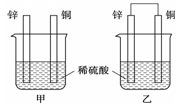
(1)以下叙述中,正确的是(填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
(2)装置乙中,总反应的离子方程式为;若导线上通过0.2 mol电子,消耗锌的质量为g。