已知一种C(H+)=1×10—3mol·L-1的酸和一种C(OH—)= 1×10—3mol·L-1的碱溶液等体积混合后溶液显碱性,其原因可能是
| A.浓的强酸和稀的强碱溶液反应 |
| B.生成了一种强碱弱酸盐 |
| C.浓的弱碱和稀的强酸溶液反应 |
| D.等物质的量浓度的一元弱酸和一元强碱溶液反应 |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是()
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
| A.①②③ | B.②③④ | C.③④ | D.①②③④ |
下列表示对应化学反应的离子方程式正确的是( )
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-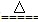 NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-===Ag++NO↑+H2O |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是()
| A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.三者对应的氧化物均为碱性氧化物 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
下列解释实验现象的反应方程式不正确的是()
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:4Na+O2==2Na2O |
| B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-==Ag2S↓+2Cl- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2H2O===4NaOH+O2↑ |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀: |
2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O
常温下,下列各组离子在指定溶液中不能大量共存的是( )
| A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO42-、CO32- |
| B.0.1 mol·L-1 NaHCO3溶液:K+、Ba2+、NO3-、Cl- |
| C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN- |
| D.c(H+)/c(OH-)=1的溶液:Ca2+、Na+、ClO-、NO3- |