有机化合物F是合成电子薄膜材料高聚物Z 和增塑剂P的重要原料。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
① 3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”) 。
② X的结构简式是 。
③ 1 mol F在O2中充分燃烧,消耗7.5 mol O2,生成8molCO2和3molH2O,1mol F与足量NaHCO3溶液反应生成2 mol CO2。其分子内的氢原子处于3种不同的化学环境。
F分子中含有的含氧官能团的名称是 。
Y+F→Z反应的化学方程式是 。
(2)已知: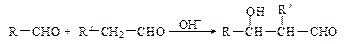 (R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。
(R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。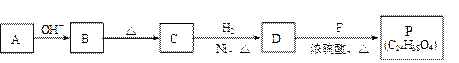
① A→B反应的化学方程式是 。
② B→C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氢原子。C的结构简式是 。
③ P的结构简式是 。
④ 符合下列条件的B的同分异构体共有(填数字) 种。
a.在酸性条 件下水解为M和N b.一定条件下M可以转化为N
件下水解为M和N b.一定条件下M可以转化为N
已知乳酸的结构简式为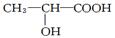 。试回答:
。试回答:
(1)乳酸分子中含有和两种官能团。
(2)乳酸跟氢氧化钠溶液反应的化学方程式:
(3)乳酸跟足量的金属钠反应的化学方程式:
(4)乳酸跟乙醇发生酯化反应生成的酯的结构简式为:
(5)相等的乳酸分别和足量的钠和碳酸氢钠反应生成气体的物质的量之比为
(9分)已知同一个碳原子上连有两个羟基是不稳定的,会失水形成羰基。试回答下列问题:
(1)写出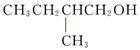 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式:
________________________________________。
(2)写出丙炔与HBr按1∶2的加成产物(氢原子加在含氢较多的碳上)在碱性条件下完全水解后产物的结构简式:_____________________________。
(3)C5H12O分子属于醇类的同分异构体有______种,若向其中加入酸性高锰酸钾溶液无明显现象,则该醇的结构简式为________________。
(8分)某芳香烃中含碳元素的质量分数为90.6%,相同条件下,其蒸气密度为空气密度的3.66倍(M空气设为29)。
(1)该烃的分子式为__________。其最简单的同系物中能使酸性高锰酸钾溶液褪色的是(写出其结构简式)__________________。
(2)若该烃硝化时,苯环上的一硝基取代物有三种,则该烃的结构简式可能为____________________。
某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为136。
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。如下图A。
方法三:利用红外光谱仪测得A分子的红外光谱如下图B。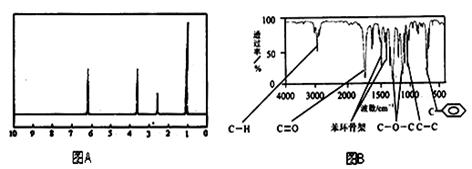
(1)分子中共有种化学环境不同的氢原子;
(2) A的分子式为。
(3) 该物质属于哪一类有机物_____________;
(4)A的分子中只含一个甲基的依据是___________________(填序号)。
a. A的相对分子质量 b. A的分子式
c. A的核磁共振氢谱图 d. A分子的红外光谱图
(5)A的结构简式为。
(6)A的芳香类同分异构体有多种,其中又同时符合下列条件:①能发生水解反应;②分子结构中含有一个甲基。则该类A的同分异构体共有_______种。
化合物A是一种酯,它的分子式为C4H8O2,有下图27转化关系。试回答下列问题。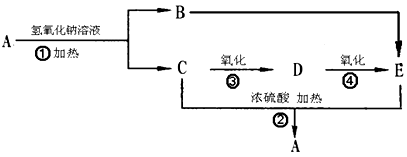
(1)化合物A是。
(2)D中含有的官能团(填名称)。
(3)E的结构简式是。
(4)反应①的反应类型是___________;
(5)反应③的化学方程式为;反应类型是________
(6)写出C 和E生成A的化学方程式。