有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与Br2的四氯化碳溶液发生加成反应,1 mol A能与1molNaHCO3溶液恰好完全反应。B所含元素种类与A相同,相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13%。试回答下列问题:

(1)A中所含官能团的名称为 。
(2)B的分子式为 ,B的同系物D的相对分子质量为60,则D可能的结构简式为 。
(3)A与B反应生成C的化学方程式为 ,该反应属于 反应。
(4)A、B的混合物共1mol,无论二者以何种比例混合,完全燃烧时下列量始终为定值的是 。
a.消耗氧气的量 b.生成水的量 c.生成二氧化碳的量
有机物A、B、C、D、E、F、G、H相互转化关系如下图所示。5.2 g F能与100 mL 1 mol/L NaOH溶液恰好完全中和,0.1 mol F还能与足量NaHCO3反应,在标准状况下放出4.48 L CO2。D的分子式为C3H3O2Na,E的分子中含有羧基。
(1)写出物质C中的官能团的名称:;
(2)写出物质F、H的结构简式;
F、H;
(3)写出反应①、④的化学反应类型:①、④;
(4)写出变化①、③的化学方程式;
①
③
(5)写出相对分子质量比B大14,且与B具有相同官能团的所有物质的结构式(不考虑立体异构)。
。
将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变,试求:
(1)原混合物中Fe2O3的质量为;
(2)原盐酸的物质的量浓度为。
(11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42-② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是(填序号)。
(3)在下列反应中,水仅做氧化剂的是(填字母,下同),水既不做氧化剂又不做还原剂的是。
| A.2F2+2H2O=4HF+O2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为。
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,C是家庭中常用的一种调味品的主要成分,D是具有果香气味的物质。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。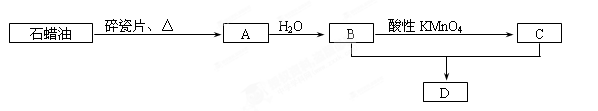
(1)A、B、C中含有的官能团分别是,,(写名称)
(2)写出反应的化学方程式
A→B:反应类型:
B+C→D:反应类型:
(3)B在Cu作催化剂的情况下可催化氧化,其方程式为
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是,最高价氧化物水化物显两性的氢氧化物的化学式是。
(2)③与④的气态氢化物的稳定性由大到小的顺序是。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为______________________________________。