(I)多项选择题
莽草酸是一种合成治疗甲型H1N1流感药物达菲的原料。鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机物的说法不正确的是 。

| A.两种酸都能与溴水反应 |
| B.两种酸遇三氯化铁溶液都显紫色 |
| C.鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| D.等物质的量的两种酸与足量金属钠反应时,产生氢气的量相同 |
E.等物质的量的两种酸与足量氢氧化钠溶液反应时,消耗氢氧化钠的量相同
(II)
近年来,金属有机化合物的研究越来越引起化学家的重视,其研究成果已应用于有机合成。

(一)二茂铁[Fe(C5H5)2]是铁的一种金属有机化合物,结构如图(E表示铁),其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: 。核磁共振法能够区分这两种结构,在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构,在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
(二)Grignard试剂是镁的一种金属有机化合物,它的合成方法是:
RX+Mg RMgX(Grignard试剂)
RMgX(Grignard试剂)
生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:(提示:H的一氯代物只有3种)

请按要求填空:
(1)3,4-二甲基-3-己醇的结构简式是 ,它是图示中的哪种物质 (填A~J的符号)。
(2)C+D→E的反应类型是______________,F→G的反应类型是________________。
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B: 。
(4)图示中的二元酸的名称是 ;I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物。试写出此高聚物的结构简式 。
从A组中选择一种最适宜的试剂(每种试剂只能选用一次),以除去B组物质的少量杂质,将正确答案的序号填入括号内,并在横线上写出相应的离子方程式。
A组:①稀盐酸 ②饱和石灰水 ③CO2 ④Cl2溶液 ⑤NaOH溶液 ⑥Fe屑
B组:(1)FeCl2溶液中的FeCl3() ________________________________
(2)镁粉中少量的铝粉() ________________________________
(3)NaHCO3溶液中的Na2CO3()_______________________________
甲、乙、丙三种物质之间有如下转化关系:
甲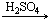 乙
乙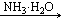 丙
丙 甲
甲
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。则甲是(填化学式)。
写出“乙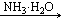 丙”转化的离子方程式。
丙”转化的离子方程式。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则丙是(填化学式)。
写出“甲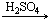 乙”转化的离子方程式:。
乙”转化的离子方程式:。
(1)除去Mg粉中的Al粉的离子方程式为;
(2)除去FeCl2溶液中少量CuCl2杂质的试剂是 ,离子方程式为;
(3)加热条件下铁与水蒸气反应的化学反应方程式为;
(4)Fe(OH)2露置于空气中转化Fe(OH)3的化学反应方程式为;
水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常温下呈酸性的溶液有(填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: 、
,该溶液中的离子浓度由大到小的顺序是:。
(3)有浓度均为0.1 mol•L-1的 ①盐酸②硫酸③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式:,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)=mol/L(忽略溶液体积的变化)。
在某温度下,将H2和I2各0.10mol的气态混合物充入l0L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。则,氢气的转化率为;该温度下,反应的平衡常数为;已知该反应为放热反应,当降低温度时,反应的平衡常数会(填“变大”、“变小”或“不变”)。