[化学一选修3:物质结构与性质]利用铜萃取剂M,通过如下反应实现铜离子的富集: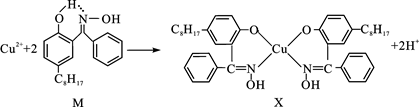
(1)X难溶于水、易溶于有机溶剂,其晶体类型为 。
(2)M所含元素的电负性由大到小顺序为 ,N原子以 轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有 (填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是 。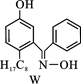
(5)基态Cu2+的外围电子排布式为 ,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是 。
| 离子 |
Sc3+ |
Ti3+ |
Fe2+ |
Cu2+ |
Zn2+ |
| 颜色 |
无色 |
紫红色 |
浅绿色 |
蓝色 |
无色 |
(11分)(1)已知丙酮[ CH3COCH3 ]键线式可表示为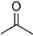 根据键线式回答下列问题:
根据键线式回答下列问题:
(1) 分子式:,结构简式:。
分子式:,结构简式:。
(2)写出乙烯分子的电子式:。
(3)有机物(CH3)2CHCH(C2H5)CH=CH2的名是。
(4)写出甲苯制TNT化学方程式。
(5)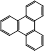 的一氯取代物有种,
的一氯取代物有种, 的二氯取代物有种。
的二氯取代物有种。
在一个容积固定的反应容器中有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应:
A、B、C、D、E、F的起始加入量分别为2mol、1mol、0mol、Xmol、Ymol、Zmol,两边反应达平衡后,隔板恰好在正中间位置。
(1)恒温时,若向左边容器中再充入0.3 mol He,则右边容器内的平衡移动(填“向左”“向右”或“不”);
(2)恒温时,若向左边容器中通入的不是He,而是2molA和1molB的气体,与原平衡相比,左边容器中C的体积分数(填“增大”“减小”或“不变”,下同),右边容器中气体平均相对分子质量;
(3)恒温时,在(2)题的平衡体系中,若向左右两容器中同时再各注入1molHe,平衡后与(2)题的原平衡体系相比,下列说法正确的是(填序号)。
A、C、F的浓度都不变
B、B的转化率、F的分解率均增加
C、A、D物质的量都增加了
D、A、B、C、D、E、F物质的量都不变
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的固体产物具有两性。
(1)若稀硝酸腐蚀锌板产生的气体N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式。
(2)在操作①中保持pH=8的目的是。
(3)沉淀I的主要成分是。
(4)操作③中加热、煮沸的目的是;
此步骤操作的理论依据是。
(5)操作④保持pH=2的目的是;
此步骤操作中所用的仪器有带铁圈铁架台、酒精灯、、。
[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 .。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。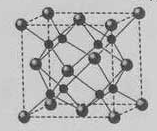
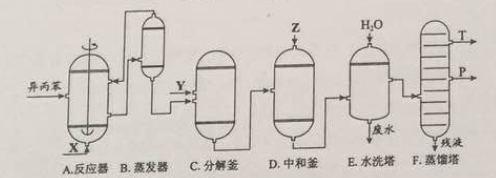
【化学——选修2:化学与技术】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)
a. NaOH b. CaCO c. NaHCO d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。