(I)多项选择题
关于化工生产的下列叙述中,正确的是 。
| A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化 |
| B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 |
| C.加热法只适用于软化暂时硬度的硬水 |
| D.工业上采用电解熔融氯化铝生产金属铝 |
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)
工业上制取硝酸铵的流程图如下,请回答下列问题:
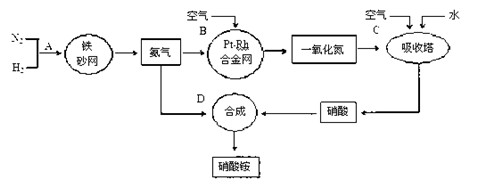
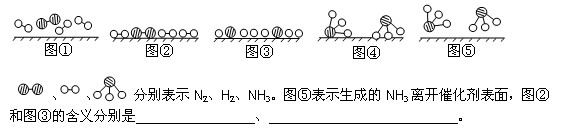
(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
(2)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
 碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
NH3还原法:8NH3+6NO2 ="======" 7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
| |
注意事项 |
理由 |
| ① |
|
|
| ② |
|
|
已知: (R、R’表示烃基或官能团)
(R、R’表示烃基或官能团)
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5 mol A完全燃烧只生成3 mol CO2和2.5 mol H2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六元环状酯类化合物。
请回答:
(1)1 mol B与足量的金属钠作用产生22.4 L(标准状况)H2。B中所含官能团的名称是。
B与C的相对分子质量之差为4,B→C的化学方程式是。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是、。
(3)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是;
②F可制得使Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是;
③F在一定条件下发生缩聚反应的化学方程式是。
(4)A的结构简式是。
由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均 已省略):
已省略):
请分析后回答下列问题:
(1)反应的类型分别是①_____________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式_________________ ;
(4)物质X与A互为同分异物体,则X的结构简式为 ______________________,
(5)A→B的化学方程式(注明反应条件)______________________________________。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标况)。 |
(3)用结构简式表示A中含有的官能团: 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有种氢原子。 |
| (5)综上所述,A的结构简式。 |
(1)下列实验操作不正确的是。(多选扣分)
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯; |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复多次,完成乙醇氧化为乙醛的实验; |
| C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇; |
| D.向试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,加热制取乙酸乙酯; |
E.实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流。
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加,至沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
(2)请同学们根据官能团的不同对下列有机物进行分类。
芳香烃:;醛:;酯:。
醇:;酚;酸
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和 13.2g。 13.2g。 |
(2)A的分子式为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能 团:。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有种氢原子。 |
| (5)综上所述,A的结构简式为:。 |