、、、、、、、、是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①、、、、能使湿润的蓝色石蕊试纸变红,能使湿润的红色石蕊试纸变蓝,、、不能使湿润的石蕊试纸变色;
②和相遇产生白色烟雾;
③和都能使品红溶液褪色;
④将红热的铜丝放入装有的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条放入装有的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥和相遇生成红棕色气体;
⑦G在中燃烧可以产生和;
⑧将和在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生。
回答下列问题:
(1)的化学式是,②中烟雾的化学式是;
(2)④中发生反应的化学方程式是 ;
;
(3)⑤中发生反应的化学方程式是;
(4)的化学式是,的化学式是;
(5)⑦中发生反应的化学方程式是;
(6)的化学式是。
(12分)已知铝土矿主要成分为Al2O3,还含有少量的Fe2O3、SiO2等杂质。下图是工业上冶炼铝的工艺流程图:
⑴操作Ⅰ和Ⅱ是用于分离溶液和沉淀,称为。需要用到哪些玻璃仪器
⑵操作Ⅰ分离出的沉淀除了含有泥沙外,一定还含有,滤液X 中,含铝元素的溶质的化学式为。写出步骤②中与过量CO2反应的化学方程式
中,含铝元素的溶质的化学式为。写出步骤②中与过量CO2反应的化学方程式
⑶操作Ⅱ得到的 沉淀除了氢氧化铝还有,它属于(填“酸”、“碱”或“盐”)类物质。
沉淀除了氢氧化铝还有,它属于(填“酸”、“碱”或“盐”)类物质。
⑷实 验室里常往氯化铝溶液中加入(填“氨水”或“NaOH溶液”),写出对应的离子方程式
验室里常往氯化铝溶液中加入(填“氨水”或“NaOH溶液”),写出对应的离子方程式
(共10分)在铝制易拉 罐中收集满CO2,然后倒入10mL浓NaO
罐中收集满CO2,然后倒入10mL浓NaO H溶液,迅速密封易拉罐口,可以观察到易拉罐突然变瘪了,原因是 _____________________,反应的离子方程式为 ___________________。
H溶液,迅速密封易拉罐口,可以观察到易拉罐突然变瘪了,原因是 _____________________,反应的离子方程式为 ___________________。
一段时间后,又可以观察到 ______________________,
原因是 ______________________,反应的化学方程式为
___________________ ___________。
___________。
(共12分)配制250mL 1.0mol/L NaOH溶液,请回答下列问题:
⑴在下列仪器中:A 托盘天平 B 量筒 C烧杯 D 玻璃棒 E 漏斗 F 500mL容量瓶
G 药匙 H 250mL容量瓶 I 胶头滴管 J 坩埚
需要用到的仪器有
⑵所需NaOH固体质量为克
⑶配制的实验步骤如下:
①计算②称量③溶解④转移、洗涤⑤定容⑥摇匀
其中第③、④、⑤步实验操作都要用到玻璃棒,作用分别是, ,
。
⑷在容量瓶内确定溶液体积的过程中,完成后期加入少量水的做法是
;
下列各项中,可能导致实际浓度偏高的是(填标号)
| A.在天平托盘上垫纸,将NaOH放在纸上称量 |
| B.NaOH溶解时放出大量的热,未冷却立即配制溶液 |
| C.溶解NaOH固体之后的烧杯未洗涤 |
| D.向容量瓶中转移液体时不慎洒出 |
⑸从上述所配制的溶液中取出10mL,其中NaOH的物质的量浓度为,NaOH的质量为,NaOH的物质的量为。
⑹将取出的10mL溶液加水稀释到100mL,稀释后溶液中N aOH的物质的量浓度为。
aOH的物质的量浓度为。
、氢氧燃料电池是符合 绿色化学理念的新型发电装置。
绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,
在导线中电子流动方向为(用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续
不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ. 2Li + H2  2LiHⅡ. LiH + H2O ="=" LiOH + H2↑
2LiHⅡ. LiH + H2O ="=" LiOH + H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度约为0.8g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
(9分)电 解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: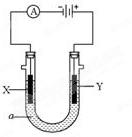
(1)X的电极名称是(填写“阳极”或“阴极”)。
(2)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是, Y电极的材料是。
Y电极的材料是。
(3)若X、Y都是惰性电极, a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是,Y极上的电极反应式为。
a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是,Y极上的电极反应式为。
(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |