Ⅰ.某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
(2)恒定温度、压强
①若x = 0,y = 0,则z _________;
②x、y、z应满足的一般条件是_______________________________。
Ⅱ.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_____和_____,或____和_____。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为: n(O2)平=a mol,n(CO2)平=b mol。
试求n(H2O)平=__________。(用含a、b的代数式表示)
当0.2mol烃A在足量氧气中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成2,2-二甲基丁烷,则
(1)A的结构简式为 ▲ ,
(2)A的命名为: ▲ 。
在有机物:①CH3CH3、②CH2=CH2、 ③CH3CH2C≡CH、
④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是▲,一定互为同分异构体的是▲。(填编号)
苯甲酸重结晶的实验操作步骤:加热溶解、 ▲ 、▲、过滤洗涤、烘干装瓶,在第一次过滤的过程前加入少量的水的目的: ▲
⑴某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。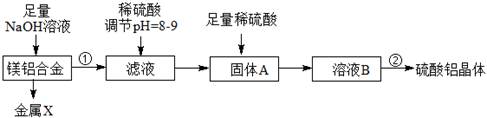
则镁铝合金中加NaOH溶液的化学反应方程式为,金属X是,
固体A的化学式,操作②包含的步骤有蒸发浓缩、、过滤、干燥。
⑵某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称,需要测定的数据有。(已知该实验时的温度压强)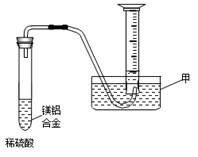
⑶现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。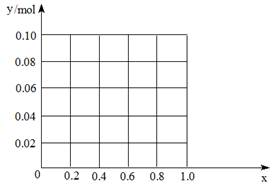
(6分) 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
⑴物质G的化学式:。
⑵物质B的电子式:。
⑶写出C→E的化学方程式:;
⑷G→F的离子方程式:。