本题包括A、B两小题,分别对应于"物质结构与性质"和"实验化学"两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。
(1) 中与互为等电子体,的电子式可表示为;1 中含有的键数目为。
(2)将乙炔通入溶液生成红棕色沉淀。基态核外电子排布式为。
(3)乙炔与氢氰酸反应可得丙烯腈。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
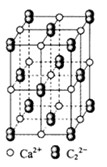
(4) 晶体的晶胞结构与晶体相似(如图所示),但晶体中含有的中哑铃形的存在,使晶胞沿一个方向拉长。晶体中1个周围距离最近的数目为。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
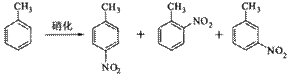
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体为催化剂(可循环使用),在溶液中,加入乙酸酐(有脱水作用),45反应1h 。反应结束后,过滤,滤液分别用5% ,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于层(填"上"或'下");放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
| n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
| 浓 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
| 1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
| 0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
|
| 0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
| 0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
| 0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
① 催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为。
催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是。
③与浓硫酸催化甲苯硝化相比,催化甲苯硝化的优点有、。
海水占地球总储水量的97.2%,若把海水淡化和加工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐________t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
请写出②④的化学反应方程式:
________________________________________________________________________
________________________________________________________________________。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为HOCH2SO3Na,根据其结构特点,“吊白块”不能发生的反应有________(填字母)。
| A.皂化反应 | B.聚合反应 |
| C.与金属钠反应 | D.氧化反应 |
工业上对海水资源综合开发利用的部分工艺流程如图所示。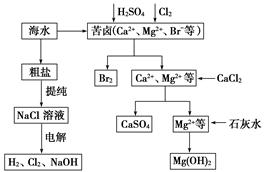
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是________。电解槽中的阳极材料为________。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?________________________________________________________________________,
原因是________________________________________________________________________
________________________________________________________________________。
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是__________________________________________
________________________________________________________________________。
海水占地球总储水量的97%以上。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上使用的“海水淡化”主要技术有_______________________________________。
(2)工业上利用电解饱和食盐水可制得重要化工产品,用离子交换膜电解槽电解饱和食盐水,反应的离子方程式是__________________________________________________________,
阳离子交换膜的作用是________________________________________________________。
若不使用离子交换膜法电解食盐水,可得到一种消毒液,其反应的化学方程式是
________________________________________________________________________。
(3)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,写出此过程中SO2被吸收以及又生成可被回收的气体的两个反应的化学方程式________________________________________________________________________。
第47届联合国大会将每年的3月22日定为“世界水日”。我国是一个淡水资源平均水平远低于世界平均水平的缺水国家,海水淡化是解决我国淡水缺乏的一种好方法,海水淡化技术成为我国“十五”期间科技攻关的一个项目,海水淡化也被誉为21世纪的朝阳产业。
(1)有一种真空蒸发式海水淡化装置,该装置利用柴油机缸套废热水加热海水,使其蒸发汽化,蒸发温度为40 ℃左右。产出的蒸汽冷凝成淡水,淡水汇入集水槽,由水泵抽出,供船上使用。该装置的原理为__________________________________,与电渗析法原理________(填“相同”或“不相同”)。
(2)海水的沸点大约为105 ℃,为什么在此条件下蒸发温度仅为40 ℃左右?
________________________________________________________________________。
(3)该淡化过程中体现了哪些资源的合理利用?
________________________________________________________________________。
(4)请你试着评价一下真空蒸发式海水淡化装置的优缺点:
________________________________________________________________________。
海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩。如图,左侧为海水,右侧为经过一段时间后由左侧经高分子膜渗透得到的淡水,分析高分子膜应具有的性质是________________________________。