工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除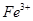 外还可能含有
外还可能含有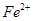 。若要确认其中的
。若要确认其中的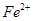 ,应先用 选填序号)。
,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性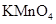 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
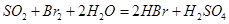
然后加入足量 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中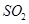 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中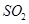 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有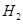 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。

(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有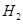 ,预计实验现象应是 。
,预计实验现象应是 。
(7)若要测定限定体积气体Y中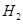 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml 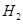 ),除可用测量
),除可用测量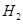 体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.2mol/L的盐酸溶液,填空并请回答下列问题:
(1) 配制250mL0.2mol/L的盐酸溶液
| 计算应称量盐酸体积/mL |
应选用容量瓶的规格/mL |
除量筒、容量瓶、烧杯外还需的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _ __ __;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是____,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作;
若加蒸馏水时不慎超过了刻度;
若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面__________________________________________________________________________。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为。
(2)溴与氯能以共价键结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为。
(3)操作Ⅱ的名称是。操作Ⅲ一般适用于分离____________混合物。(选填编号)
| A.固体和液体 | B.固体和固体 | C.互不相溶的液体 | D.互溶的液体 |
(4)混合②中加入Na2SO3的目的是。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为. 乙同学取制得的氢溴酸少许,向其中加入CCl4,有机物层变为橙色,则证明在该溶液中含有_________。
某化学课外小组同学在实验室做酸碱中和滴定实验,他们准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.2000mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
| NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
| 第一次 |
0.02mL |
18.60mL |
| 第二次 |
0.04mL |
18.66mL |
| 第三次 |
0.20mL |
20.60mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为mol/L。(精确到0.0001)
(2) 下列有关滴定的操作正确的顺序是
①用标准液润洗滴定管②往滴定管中注入标准溶液
③检查滴定管是否漏水④滴定⑤加水洗涤
A.⑤①③②④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.2000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?填 “是”或“否”)
(5)另一小组同学用标准盐酸滴定未知浓度的NaOH溶液,若测定结果偏高,则产生误差的原因可能是
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,未用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.配置NaOH溶液时,NaOH固体中混有少量KOH固体
(10分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.100 0 mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。(保留4位有效数字)
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在55~60 ℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸的混合酸时,操作注意事项是___________________________。
(2)步骤③中,为了使反应在55~60 ℃下进行,常用的方法是____________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是________________________________________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是_________________________________________。
(5)纯硝基苯是无色、密度比水________(填“小”或“大”)的油状液体,它具有________气味。