工业上用固体硫酸亚铁制取Fe2O3,反应原理是: 2FeSO4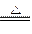 Fe2O3 +SO2 ↑+SO3 ↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
Fe2O3 +SO2 ↑+SO3 ↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)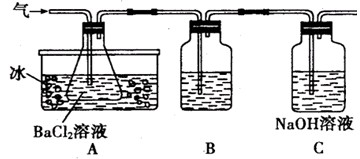
请回答相关问题:
(1)Fe2O3俗称为 不溶于水而易溶于酸,Fe2O3与稀盐酸反应的离子方程式为
(2)A瓶所盛试剂的作用是 C瓶所盛试剂的作用是
,用冷水冷却的原因是 ;B瓶所盛的试剂是
(3)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是 (填编号)
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 | C.逸出SO3气体 | D.逸出SO2气体 |
理由是
(4)在用固体硫酸亚铁制取Fe2O3的反应中,还原产物是 ,标准状况下每生成11. 2L SO2气体,转移电子的物质的量为 mol.
(12分)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)烧杯间填满碎木屑的作用是__________________________。
(2)环形玻璃搅拌棒能否用环形铜质搅拌棒代替? (填“能”或“不能”),其原因是_______________________________。
(3)为什么要用0.55 mol·L-1的氢氧化钠溶液?
____________________________________________________;
实验中若改用60 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所测得的中和热 (填“相等”或“不相等”)。
有甲、乙两位同学想利用下列装置及化学试剂,对实验室制取并收集氨气的实验进行改进。
化学试剂:①NH4Cl固体②浓氨水③固体NaOH
(1)甲同学想方便快速制取少量氨气,应选择的装置是_________ (填序号)。
选用试剂是_________(填序号) ,选用上述试剂制氨气的理由是___________________。
(2)乙同学建议,把教材中实验室制取氨气的收集装置由大试管改为集气瓶且瓶口向上收集氨气,并确保不污染环境,若用这种排气法收集氨气,请在图Ⅱ的方框内画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸mL(1分)
(2)配制时,必须使用的仪器有 (填代号)(1分)
①烧杯 ②100 mL量筒 ③20 mL量筒④1000 mL容量瓶⑤250 mL容量瓶⑥托盘天平(带砝码)⑦ 玻璃棒;还缺少的仪器是 。(1分)
玻璃棒;还缺少的仪器是 。(1分)
(3)配制时,该实验两次用到玻璃棒,其作用分别是、。(各1分)
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”
“不影响”)
①没有洗涤烧杯和玻璃棒。 。(1分)
②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。(1分)
③容量瓶没有干燥。 (1分)
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: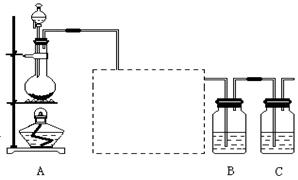
(1) 装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是。
,烧瓶中加入的试剂是。
(2)画出虚线框内的实 验装置图,并注明所加试剂,说明装置的作用。
验装置图,并注明所加试剂,说明装置的作用。
(3) 装置B中盛放的试剂是(此空选填下列所给试剂的代码),实验现象为,化学反应方程式是,该反应属于四种基本反应类型中的反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4) 还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属 性?简述你的理由。
性?简述你的理由。
(14分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
I.合成苯甲酸甲酯粗产品
在园底烧瓶中加人12.2g 苯甲酸和20 mL 甲醇(密度约0.79g · mL-1) ,再小心加人3 mL 浓硫酸,混匀后,投人几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:__________________。
(2)甲和乙两位同学分别设计了如下图两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用__________装置(填“甲”或“乙”)。理由是___________________。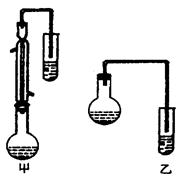
(3)反应物CH3 OH 应过量,理由是__________________________________。
II.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填人恰当操作方法的名称。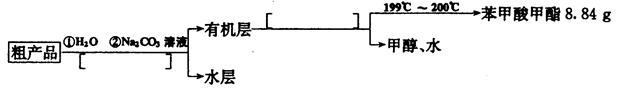
(5)以上流程图中加人Na2CO3溶液后,放人分液漏斗中振荡、静置,要得到有机层,其具体操作是______________________________________________________________________
(6)通过计算,苯甲 酸甲酯的产率为_________________________。
酸甲酯的产率为_________________________。