快乐是什么?精神病学专家通过实验发现:在大脑的相应部位——“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.
多巴胺结构如图:
(1)多巴胺分子式: .
(2)试判断多巴胺能发生的化学反应 .
| A.加成 | B.取代 | C.氧化 | D.水解 |
(3)写出与多巴胺互为同分异构体且满足下列三个条件的所有物质的结构简式:
①属于1、3、5三取代苯 ②苯环上直接连有一个羟基和一个氨基
③分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1
.
(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得.合成过程表示如下: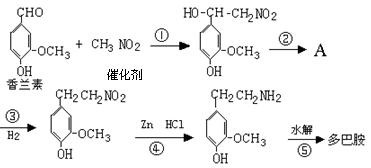
(Ⅰ) 写出下列反应类型:反应① ,反应⑤ .
(Ⅱ) A的结构简式: .
(Ⅲ) 写出②的化学方程式: .
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO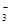 +4H++3e-→NO+2H2O
+4H++3e-→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质甲为 ,在该反应中作 剂。
(2)写出并配平该氧化还原反应的离子方程式: 。
(3)反应中若转移电子0.6mol,则产生气体在标准状况下的体积为 。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O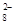 +2I-=2SO
+2I-=2SO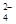 +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程: 、 。
某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。
(1)该溶液中一定含 。(填化学式)
(2)写出图中a点之前的离子方程式: ;
写出图中a→b点的离子方程式: 。
(3)将所得沉淀进行过滤,洗涤,干燥,称量,应如何判断沉淀是否完全洗净:
。
(4)若b点时沉淀质量=2.94克,V1=20mL,V2=40mL,求C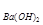 = 。
= 。
(1)若a克某气体中含有的分子数为b,则c克该气体在标准状况下的体积是(用NA表示阿伏加德罗常数)
(2)若同温同压下,m克A气体与n克B气体的分子数相同,则气体A与B在标况下的密度之比为 ,同质量的气体A与B的分子数之比为 。
(3)若以24克12C中所含的碳原子数为阿伏加德罗常数,则下列数值如何变化:(填“增大”、“减小”或“不变”)
O2的摩尔体积 ;O2的摩尔质量 ;同温同压下,一定质量O2的体积 ;同温同压下,一定体积O2的分子个数 。
有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;
⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;
属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: 。
① 44.8L某气体在标准状况下的质量为142g,该气体的摩尔质量为_________;
② N2在标准状况下的密度为__________g/L;
③在mol AL2(SO4)3中含0.3molSO42—,其中含Al3+个。