利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g) + O2(g) === 2NO(g) △H= +180.5kJ/mol
N2(g) + 3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g) + O2(g) ="==" 2H2O(g) △H=-483.6kJ/mol
若有17 g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)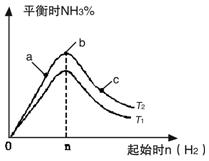
①图像中T2和T1的关系是:T2 ______T1(填“高于”、“低于”、
“等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最 高的是______(填字母)。
③在起始体系中加入N2的物质的量为________mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________________________。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)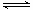 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
则500s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐W#W$W%.K**S*&5^UNa2CO3组成的燃料电池,采用电解法制备N2O5,
装置如图所示,其中Y为CO2。
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式____________________________。
②以下是对硝酸型酸雨的评价,其中正确的是_________________________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_______。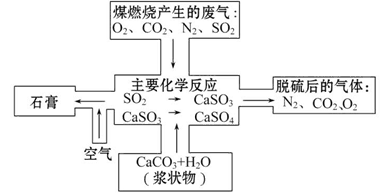
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)_______,它对环境的负面影响是____________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是_________________________。
某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银。步骤如下
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用________硝酸(填“浓”或“稀”)。原因是________ (填序号,下同)
a.减少过程中产生NOx的量
b.减少原料银的消耗量
c.节省硝酸的物质的量
(2)步骤B加热保温的作用是________。
a.有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是________。
a.置换反应
b.水解反应
c.氧化还原反应
产生的沉淀物化学式________。
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________;若只能在加热情况下进行,则反应物A应为______________;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为________________________________________。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。请回答:
(1)A是_______、B是_______、C是_______ (请填化学式)。
(2)反应①的化学方程式为: ___________________________________。
(3)反应③的离子方程式为: _________________________________________。
(4)反应④的离子方程式为:___________________________________________。
A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于第________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是_______________________。
(2)易与C发生化学反应的酸是______ (填名称),反应的化学方程式是_______。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学方程式:______________________________________,___________________________________________________________________。
②要将NaOH高温熔化,下列坩埚中不可选用的是_________________________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。