某溶液中可能含有Na+,K+,Br—,SO42-,CO32-等离子中的全部或其中的几种,现分别取三份溶液,进行如下操作:
a.用洁净的铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;
b.溶液中通入氯气,溶液由无色变为橙色;
c.溶液中加入过量的稀硫酸后,无气体放出,再加入Ba(NO3)2溶液后,产生白色沉淀.
(1)原混合液中一定存在的离子是 ,一定不存在的离子是 .
(2)为确定 离子是否存在,只需将c操作中如何改进?______________
(3)为确定 离子是否存在,应补充的实验操作是 。
取质量为4.6g的纯净的金属钠平均分成两等份,做如下实验:
(1)第一块直接投入适量的水中,充分反应后得到了气体A和200mL溶液(甲);
(2)另一块在干燥氧气中受热后转化成3.5g固体(经检验固体中不含金属钠的单质),再将所得固体全部投入适量的水中,充分反应后得到气体B和200mL溶液(乙)。求:
①同温同压下,气体A和气体B的密度之比为;
②溶液甲的物质的量浓度=;
③溶液的物质的量浓度:甲乙(填 “>”、“=”、“<”、“无法确定”);
④3.5g固体所含成分是。
| A.只含Na2O | B.只含Na2O2 |
| C.既含Na2O又含Na2O2 | D.无法确定 |
甲、乙、丙、丁、X是中学阶段的五种常见物质,它们的转化关系如下图所示(部分产物已略去):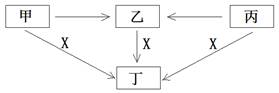
(1)若甲、乙、丙、丁均为化合物,且焰色反应均呈黄色。丙是淡黄色固体,常温下X是一种无色无味气体。则:
①甲和X生成丁的化学方程式为:
②丙和X生成丁的反应中还原剂是(填化学式),有0.2mol丁生成时,电子转移的数目是。
(2)若甲、乙、丙、丁都含有地壳中含量最多的金属元素,且丙受热时分解生成乙。X、丁溶液的焰色反应均为紫色(透过蓝色钴玻璃)。
①图中五个转化中属于氧化还原反应的数目是
| A.2 | B.3 | C.4 | D.5 |
②乙和X生成丁的离子方程式为。
③溶液中生成的丙能够净水,其原因是。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,实验小组利用A制备Al(OH)3的操作流程如下: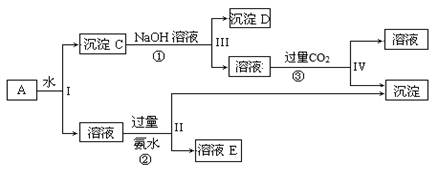
据此回答下列问题:
(1)I、II、III、IV四步中分离溶液和沉淀所采取的操作名称是,该实验操作所用到的玻璃仪器有。
(2)根据上述流程,写出D、E所含物质的化学式:
沉淀D;溶液E、。
(3)写出②、③反应的离子方程式:
②;③;
在100 mL MgCl2和AlCl3的混和溶液中,逐滴加入1 mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,
则:
(1)图中C点表示加入mLNaOH,AB段发生的离子反应方程式。
(2)c(MgCl2)=mol·L—1
(3)图中线段OA︰AB=。
某大理石含有的主要杂质是氧化铁,以下是提纯该大理石的实验步骤:
(1)溶解大理石时,用硝酸而不用硫酸的原理是:。
(2)操作Ⅰ的目的是:,该反应的离子方程式是:。
(3)写出加入(NH4)2CO3所发生反应的离子方程式:,
滤液A的一种用途是。