( 14 分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍―镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下: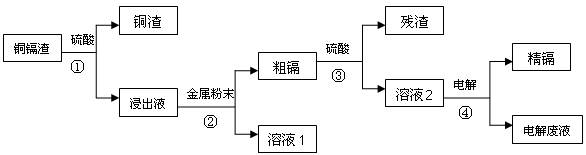 请回答下列问题:
请回答下列问题:
(1)镉元素位于周期表中第 周期,第 族,其原子结构示意图为 ;
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
聚酯纤维(的确良)的结构简式为: 它是由A和B两种单体缩聚而成。已知甲苯能在高锰酸钾存在下氧化成苯甲酸。现要以二甲苯、乙烯为原料,无机试剂可自选合成聚酯纤维(的确良)。
它是由A和B两种单体缩聚而成。已知甲苯能在高锰酸钾存在下氧化成苯甲酸。现要以二甲苯、乙烯为原料,无机试剂可自选合成聚酯纤维(的确良)。
(1)在下面方框内设计合成路线的流程图(出框部分不得分)。
(2)上述合成过程中发生缩聚反应的化学方程式是。
有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
(1)有机物A的相对分子质量为 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。 |
(2)9.0g有机物A完全燃烧时,经计算: 生成CO2共为mol, 生成的H2Og, 有机物A的分子式。 |
| (3)经红外光谱测定,证实其中含有-OH键,-COOH基团,C-H键;其核磁共振氢谱有四组峰,面积比为1﹕3﹕1﹕1。 |
(3)A的结构简式 |
| (4)经红外光谱测定,A的一种同分异构体中,存在-OH键,还含有醛基,C-O键;其核磁共振氢谱有五组峰,面积比为1﹕2﹕1﹕1﹕1。 |
(4)A的同分异构体的结构简式 |
| (5)如果经红外光谱测定,A的一种同分异构体中,存在-OH键,还含有C=O,C-O键; 其核磁共振氢谱有两组峰,面积比为1﹕2。 |
(5)A的同分异构体的结构简式 |
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO的危害在于(填以下项目的编号)
| A.破坏臭氧层 | B.高温下能使一些金属氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+ 离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+ 和亚硝酸根离子(NO2-)在酸性水溶液中反应的离子方程式: 。
下表是某橙汁饮料包装袋上的说明:
| 品名 |
浓缩橙汁 |
| 配料 |
水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
| 鲜橙原汁含量 |
≥20% |
| 净含量 |
1.5L |
| 生产日期 |
标于瓶盖上 |
(1)配料中属于着色剂的是
(2)该橙汁饮料(填“含有”或“不含”)防腐剂。
(3)上述各种配料中,国家对、的含量进行严格规定加以控制。
要使垃圾中宝贵的再生资源得到充分利用,必须对垃圾进行分类。下图是一些地区采用的垃圾分类图标。
(1)图C的文字已模糊不清,从图中可以看出它表示的是
| A.可回收物 | B.可堆肥垃圾 | C.可燃垃圾 | D.有害垃圾 |
(2)上述各图中适宜于堆肥处理的垃圾是
(3)图D表示的垃圾若随意丢弃,会造成环境污染,这种污染通常称为。
(4)图A废电池需要集中处理,主要原因是电池中含有的掺入生活垃圾中进行填埋时,会通过渗液污染水体和土壤。