下表是元素周期表的前三周期:
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 一 |
A |
|
|
|
|
|
|
|
| 二 |
B |
|
|
C |
D |
E |
F |
|
| 三 |
G |
|
H |
|
|
|
I |
J |
回答下列问题:
⑴ 写出下列元素的元素的符号:F__________、J__________。
⑵ G元素与E元素形成的化合物的化学式是____________、____________,它们都是______________(填“离子”或“共价”)化合物。
⑶ 表格中十种元素的最高氧化物对应的水化物中,酸性最强的是____________,属于两性氢氧化物的是______________(用化合物的化学式表示)。
⑷ 只含有A、C两种元素的化合物称为____________,这些化合物中:
① 相对分子质量最小的是____________,该化合物的分子空间构型是_____________;
② 分子中含有双键,但原子数最少的是_____________,其电子式是__________________,它与HCl反应的化学方程式为____________________________________________________;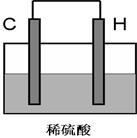
⑸ 将H单质与C的一种单质(导体)按如右图装置连接,
该装置名称为_____________。
其中C极为______________,
在该处能观察的现象是______________________________,
该电极反应式为:__________________________________。
请在右图上标出电子流动方向。
肉桂醛在食品、医药化工等方面都有重要应用。
(1)下列是合成肉桂醛、制备肉桂酸的反应路线: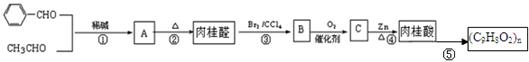

实验表明:
Ⅰ. A既能发生银镜反应,又能与金属钠反应放出氢气;
Ⅱ. 肉桂醛的相对分子质量不超过140,其中碳氢元素质量分数为87.89%。
Ⅲ. 核磁共振氢谱表明肉桂醛分子中有六种氢,其峰面积之比为1:1:1:2:2:1;
(1)A中含有的官能团为
(2) 请写出肉桂醛的结构简式。
————————————————————————————
(3) 已知反应①的原子利用率为100%,请写出第①步的化学反应方程式。
(4)反应(1)的反应类型反应(2)的反应类型为
(5) 请写出上述合成路线中使用③④两步反应的目的。
(6)写出反应⑤的化学方程式。
(7) 请写出与肉桂醛互为同分异构体,且同时满足 a.分子中无甲基,b.所有碳原子一定在同一平面上c、苯环上一氯代物只有两种的有机物的结构简式。
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度 越大。
越大。
H2CO3
 + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7

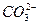 +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11
HclO  H++
H++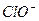 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
有少量气泡产生,溶液浅黄绿色褪去;
② 过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③ 为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
① 反应后所得的溶液漂白性增强的原因是_____________________
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有_______。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。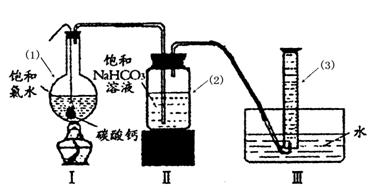
请回答:
③写出仪器(1)与仪器(3)的名称
(1)(3)
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是。
⑤如何准确读出量筒中气体的体积
a_________
b 上下移动量筒至量筒内液面与水槽液面相平
c
浓硫酸与木炭粉在加热条件下反应:C+2H2SO4(浓) CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
Ⅰ、第一小组用下图所示各装置设计一个实验,验证上述反应所产生的三种产物。 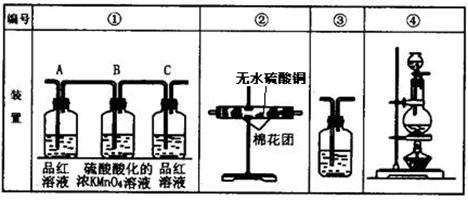
(1)这些装置的连 接顺序(按产物气流从左到右的方向)是(填装置的编号):
接顺序(按产物气流从左到右的方向)是(填装置的编号): ④ →__________→__________→__________。
④ →__________→__________→__________。
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液变化体现了SO2 性,B瓶溶液反应是利用SO2 性。
B瓶溶液的作用是 ,
C瓶溶液的作用是 。
(3)实验时装置②中看到现象是 。
(4)装置③中所加的试剂名称是 ,现象是 。
Ⅱ、另一小组为测得CO2和SO2的质量,并算两者物质的量比,设计下列实验:
将生成气体依次通过X溶液→浓硫酸→碱石灰1→碱石灰2,并设法让气体完全被吸收。
(1)下列试剂中可以充当X的是: ( )
| A.BaCl2溶液 | B.Ba(OH)2溶液 |
| C.滴加H2O2的BaCl2溶液 | D.滴加H2O2的Ba(OH)2溶液 |
(2)实验结束后,在X溶液中得到的沉淀通过过滤、洗涤、烘干、称重,称得质量为ag。称得碱石灰1在实验前后 增重质量为bg。用a、b表示CO2和SO2的物质的量比 。
增重质量为bg。用a、b表示CO2和SO2的物质的量比 。
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。该反应的离子方程式为________________________________________________。
提出合理假设。该实验中反应速率明显加快的原因可能是__________。
| A.反应放热导致温度升高 | B.压强增大 |
| C.生成物的催化作用 | D.反应物接触面积增大 |
初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验编号 |
铜片质量/g |
0.1mol·L-1的硝酸体积/mL |
硝酸铜晶体/g |
亚硝酸钠晶体/g |
实验目的 |
| ① |
5 |
20 |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
||
| ② |
0.5 |
a是盛有标准状况下的空气(氧气占1/5)和10mL 1.2mol/L硝酸的250 mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了的弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。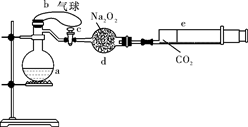
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中 ),则可观察到的现象是 。(2分)
),则可观察到的现象是 。(2分)
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施。
①若用加入化学试剂法,下列试剂中可以选用的是 。
| A.蒸馏水 | B.无水醋酸钠 |
| C.石墨 | D.少量硝酸银溶液 |
②将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是4NO2+O2+2H2O===4HNO3或4NO+3O2+2H2O===4HNO3 ,此时气球是全在烧瓶外还是一部分进入烧瓶 。
③打开弹簧夹,将二氧化碳反推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳 mL。
④将上述全过程用一个总的化学方程式表示: 。