下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号) 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
D处使用碱石灰的作用是 。
(3)检验乙醇氧化产物时F中的实验现象是 。
(4) E处是一种纯净物,其反应方程式为 。
(5)写出乙醇发生催化氧化的化学方程式 。
(共9分)现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。回答有关问题:
(共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
①气体X的分子式是。
②所选择的药品a是,b是, c是。
③下列装置乙和丙,能代替装置甲的简易装置是(填“乙”或“丙”)
④请写出在试管a中所发生反应的化学方程式。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出;;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为(填“正确”或“不正确”),依据是:;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象:。
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)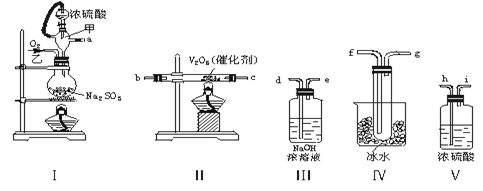
(1)这些装置的连接顺序(按气体左右的方向)是→→→→→→→→(填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是。
(4)Ⅳ处观察到的现象是。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为。
(1) 体积相同,pH相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率_____________,充分反应后,产生氢气的量_____________(相同、盐酸的多、醋酸的多)
(2) 在一定量的盐酸溶液中加入足量的锌粒,若使产生氢气的量保持不变,但反应速率加快,可加入__________晶体,要使产生氢气的量不变,但反应速率减慢,可加入____________晶体。
可选择的晶体有:
| A.纯碱 | B.烧碱 | C.胆矾 | D.醋酸钠 (E) KHSO4 |
(3)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
在虚线框内连接合适的装置___________________
②若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量____________________________________。
③实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
(7分)用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1) 滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________________________。
滴定终点的现象是:________________________________
(2) 有关数据记录如下:
| 滴定序号 |
待测液体积(ml) |
所消耗盐酸标准液的体积(ml) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.55 |
| 2 |
20.00 |
6.00 |
25.95 |
纯度计算:烧碱样品的纯度为________________。
(3) 对几种假定情况的讨论:(填无影响、偏高、偏低)(说明:测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果__________。