(5分)《硫酸铜晶体里结晶水含量的测定》是中学化学中的一个重要实验,请回答下列该实验的相关问题。
(15)实验中能直接加热的仪器名称为____________;进行的称量操作至少为________次。
(16)下列操作会引起测定结果偏高的是__________________
| A.加热时温度过高CuSO4发生分解 | B.加热后在空气中冷却再称量 |
| C.加热过程中有晶体溅出 | D.晶体部分风化 |
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是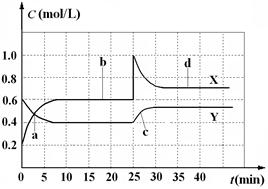
| A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与d相同的状态,在25 min时还可以采取的措施是适当缩小容器体积 |
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。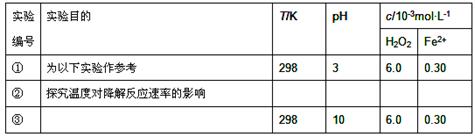
[数据处理]实验测得p-CP的浓度随时间变化的关系如图。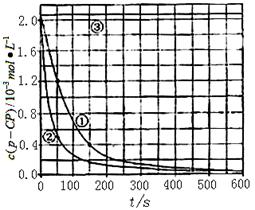
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率: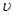 (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度 过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(4)实验③得出的结论是:pH等于10时,。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:。
某同学设计了以下操作流程来除去混在氯化钠固体中的少量硫酸钠和氯化钙。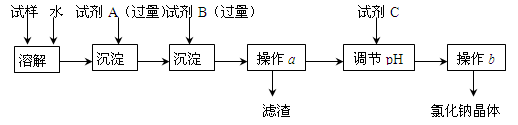
(1)试剂A是,试剂A需要过量的原因是。
(2)操作a得到的滤渣的成分是,在实验室中进行操作a需要的仪器是:铁架台(带铁圈)、滤纸、烧杯、 、。
(3)加入试剂C调节滤液pH的离子反应方程式是。
(4)该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积,部分装置如下图: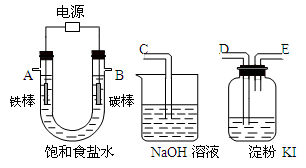
①碳棒接直流电源的_____极; 铁棒上发生的电极反应为。
②说明氯气具有氧化性的实验现象是。
③将上图中的仪器,连成一整套装置,各种仪器接口的连接顺(填编号)是B接,接。在答题卡的方框中画出与A接口连接的仪器的装置图。
Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是;但该装置存在缺陷,请指出。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象A.;B.;C.。从环保角度考虑,该装置有明显不足,请指出提出改进建议。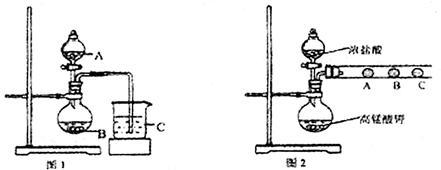
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的极相连。阴极上的电极反应式为。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:
。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
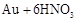  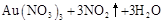 |
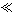 1 1 |
| 2 |
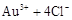  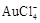 |
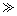 1 1 |
请根据以上信息简要解释溶解阳极泥能够溶于王水的原因
。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。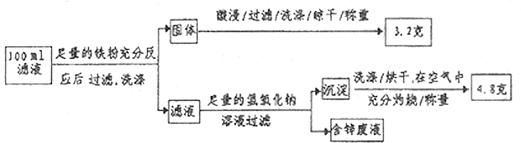
则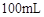 滤液中
滤液中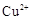 的浓度为
的浓度为 ,
,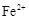 的浓度为
的浓度为 。
。
用下图装置进行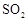 转化为
转化为 的转化率测定实验:
的转化率测定实验: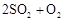
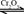
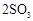
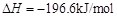 。已知:
。已知:
熔点(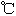 ) ) |
沸点(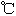 ) ) |
|
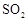 |
-72.4 |
-10 |
 |
16.8 |
44.3 |

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。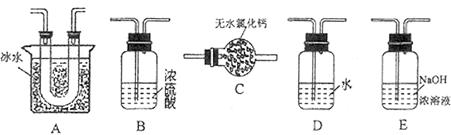
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程)。
(3)实验时,浓硫酸有顺利滴入烧瓶中,甲装置所起作用的原理是
。
(4)开始实验时,先从乙处均匀通入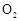 ,为使
,为使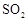 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是。
(5)实验中“当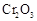 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是;若用大火加热有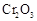 处的反应管时,
处的反应管时,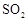 的转化率会(填“升高”、“降低”或“不变”)。
的转化率会(填“升高”、“降低”或“不变”)。
(6)实验时若用25.2g的 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入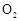 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中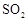 的转化率为%(保留小数点后一位)。
的转化率为%(保留小数点后一位)。