乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室用无水乙醇与乙酸制备乙酸乙酯的化学方程式如下:
CH3COOH+C2H5OH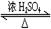 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= 。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验 编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 |
饱和碳酸钠溶液 |
5.0 |
| B |
3mL乙醇、2mL乙酸 |
0.1 |
|
| C |
3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 |
1.2 |
|
| D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |

①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
②分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 。
下表是周期表中的一部分,根据A—K在周期表中的位置,按要求回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
|||||
| 3 |
E |
F |
G |
H |
I |
J |
K |
(1)上表A—K元素中,只有负价而无正价的元素是(写出元素名称,下同),金属性最强的元素是,原子半径最小的元素是
(2)比较D-、E+及K-的离子半径,由大到小的顺序为:
(3) 气态氢化物最稳定的是(填物质的化学式) 。写出元素 C、K的气态氢化物相互反应的现象,反应化学方程式为:。
。写出元素 C、K的气态氢化物相互反应的现象,反应化学方程式为:。
(4) (本小题均填物质的化学式)在最高价氧化物的水化物中,碱性最强的是(填物质的化学式,下同),酸性最强的是,呈两性的是,写出元素E、K的最高价氧化物对应水化物相互反应的离子方程式为
某物质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题: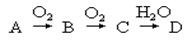
(1)若A常温下为淡黄色固体单质,B是有刺激性气味的无色气体。
①组成A的元素在周期表位置为 ;
对应离子的结构示意图为
②写出B→C反应的化学方程式:
③若将B通入品红溶液中,现象 体现了B的
性;若将B通入紫色的石蕊溶液中,现象
体现了B的水溶液的性。
④D的浓溶液在加热条件下可与铜反应并生成B气体,该反应的化学方程式为:
。
(2)若A在常温下为气体,且能使湿润的红色石蕊试纸变蓝;C是红棕色气体。
①A、C的化学式分别是:A ,C
②写出A→B反应的化学方程式:
③若将A通入滴有酚酞的水中,现象 请用 方程式表示其原因:
方程式表示其原因:
;
④D的浓溶液可与铜反应并生成C气体,则该反应的化学方程式为:
。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米管伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其原理可表示为:
□C+ □K2Cr2O7+ □H2SO4=□CO2+ □Cr2(SO4)3+ □K2SO4+□H2O
(1)请配平上述化学方程式, 将有关的化学计量数依次填在下列横线上
、、、、、、
(2)上述反应中的氧化剂是(填化学式,下同),还原剂是。
(3)H2SO4在上述反应中表现出的性质是(填选项序号)。
| A.氧化性 | B.氧化性和酸性 | C.酸性 | D.还原性和酸性 |
(4)若反应中电子转移了0.8 mol,则产生的CO2在标准状况下的体积为。
Ⅰ、有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒醮取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”)。
(2)如不正确,是否一定有误差?答: (填“是”或“否”)
(3)若按此法分别测定C(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
Ⅱ、
(1)如图表示50mL滴定管中液面的位置,其读数是 mL
(2)乙二酸俗名草酸,某化学学习小组的同学欲探究测定
|
草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。请回答:
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性: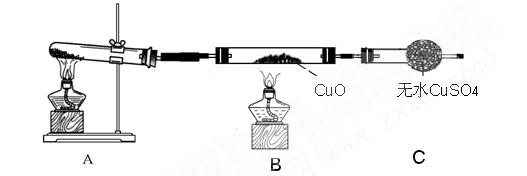 (3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差(Cu+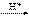 Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是________________________________。