(10分) (1)在一定条件下,容积为 10 L密闭容器中发生反应:
CH4(g)+H2O(g) 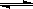 CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器 3 s时有0.1 mol CO生成,则3 s内该反应的平均速率v(H2)= 。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) 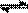 CH3OH(g)。CO的转化率与温度、压强的关系如图。
CH3OH(g)。CO的转化率与温度、压强的关系如图。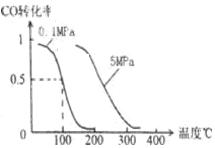
①该反应是 反应(填“放热”或“吸热”)。
②150℃时该反应的平衡常数K V2/a2(填“=”“<”或“>”)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,和b mol CH3OH(g),则达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”或“无法确定”),平衡常数 (填“增大”、“减小”或“不变”)。
已知尿素的结构式为: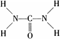 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)基态Fe3+的核外电子排布式为;C、N、O三种元素的第一电离能由大到小的顺序是。
(2)尿素分子中N原子的杂化方式是。
(3)NH+4中H—N—H键角比NH3中H—N—H键角大,原因为。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。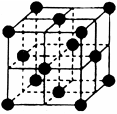
①1个CO2分子周围等距离且距离最近的CO2分子有个。
②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为 g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为cm3
g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为cm3
下图表示某些化工生产的流程(部分反应条件和产物略去)
(1)反应Ⅰ需在500℃进行,其主要原因是。
(2)G转化为H的过程中,需要不断补充空气,其原因是。
(3)写出反应Ⅲ的化学方程式。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是(填序号)。
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称。
运用化学反应原理研究氮、碳、硫等单质及其化合物的反应有重要意义。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”)184.4 kJ。
②已知
1mol N—H键断裂吸收的能量等于kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g) 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: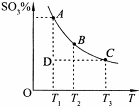
①该反应的 0(填“>’或“<”)。
0(填“>’或“<”)。
②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液)。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式。
Na2CO3水溶液呈碱性,其原因是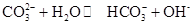 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH=。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH=。
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为(用元素符号表示)。
(3)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。
①[B(OH)4]-中B的原子杂化类型为;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得右图所示的金刚砂(SiC)结构;若在晶体硅所有Si—Si键中插入O原子即得SiO2晶体。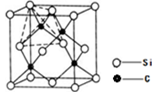
①在SiC中,每个C原子周围最近的C原子数目为;
②判断a. SiO2,b.干冰,c.冰3种晶体的熔点从小到大的顺序是(填序号)。
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —571.6kJ/mol;
H2(g)+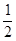 O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l) △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)  CH3OH(g),下列表示该反应达到平衡状态的标志有(填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有(填字母序号)。
| A.有1个H—H键生成的同时有 3个C—H键生成 |
| B.CO百分含量保持不变 |
| C.容器中混合气体的压强不变化 |
| D.容器中混合气体的密度不变化 |
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+ CO2(g)△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+ CO2(g)△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应v(正)v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。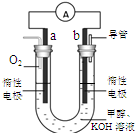
①该电池工作时,OH— 向极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为。