我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1) 沉淀池中发生的化学反应方程式是 。
(2) 写出上述流程中X物质的分子式 。
(3) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(5) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(6) CO2是制碱工业的重要原料,目前,常用的两种制碱方法中CO2的来源有何不同? 。
在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
(1)x=__________
(2)正反应是放热反应,则升高温度,正反应速率,逆反应速率。(填升高、降低或不变)
(3)B的转化率为_________。
(4)能判断该反应达到平衡状态的依据是________(填字母)
| A.混合气体的密度不变 |
| B.容器中的压强不再变化 |
| C.生成D的反应速率是生成B的反应速率的2倍 |
| D.单位时间内生成3molA,同时生成1molB |
下列微粒之间,属于同位素的是,属于同素异形体的是,属于同分异构体的是属于同一物质的是。
| A.正丁烷与异丁烷 |
| B.红磷与白磷 |
| C.H2和D2 |
| D.石英与干冰 E. 金刚石与水晶 F. 氧气和臭氧 |
G. 13C和14C H. CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白。
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
||
| 2 |
① |
② |
③ |
④ |
⑤ |
||||
| 3 |
⑥ |
⑦ |
⑧ |
⑨ |
|||||
(1)①②⑥⑦中原子半径最小的是(填元素符号);
(2)表中氧化性最强的单质的化学式为;
(3)这些元素的最高价氧化物的水化物中,碱性最强的是(填化学式);
(4)⑥⑦两种元素中,离子半径较小的是(填离子符号);
(5)④⑧⑨三种元素的气态氢化物的稳定性强弱顺序为>>(填化学式);
(6)表中能形成两性氢氧化物的元素是_____(填元素符号),分别写出该元素的氢氧化物与⑥、⑧的最高价氧化物对应水化物反应的化学方程式:
______________________________,_______________________________;
在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2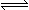 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则: (1)2min内,平均反应速率v(O2)=; v(SO3)=。
(1)2min内,平均反应速率v(O2)=; v(SO3)=。 (2)2min时,SO2的浓度为
(2)2min时,SO2的浓度为 (3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
某烃0.5 mol A完全燃烧时,得到1.5 mol 水和67.2 L二氧化碳(标准状况)。
(1)A的结构简式为___________________。
(2)根据下列条件写出有关反应的化学方程式:
①在加入Fe粉后,A与液溴反应生成B___________________________________。
在加热和催化剂作用下A与H2反应生成C________________________________。