下列微粒之间,属于同位素的是 ,属于同素异形体的是 ,属于同分异构体的是 属于同一物质的是 。
| A.正丁烷与异丁烷 |
| B.红磷与白磷 |
| C.H2和D2 |
| D.石英与干冰 E. 金刚石与水晶 F. 氧气和臭氧 |
G. 13C和14C H. CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5
(11) 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)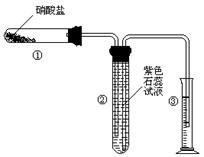
(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式:、。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式:;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3 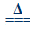 2Ag2O+4NO2↑+O2↑(Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑(Ⅱ)2AgNO3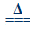 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是,并说明理由:。
请你设计一个简单的实验证明你的结论是正确的:。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律:。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
用作软质隐形眼镜材料的聚合物E是: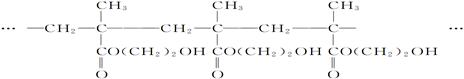
一种合成聚合物E的路线如下:
A
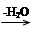

已知: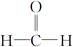 +R—CH2—CHO―→
+R—CH2—CHO―→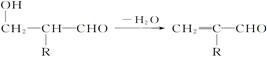
回答下列问题:
(1)A能与新制Cu(OH)2反应产生砖红色沉淀,A的结构简式是__________;
(2)D中含有的官能团名称为__________________;
(3)D→E的反应类型是____________反应;
(4)C有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有________种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1∶1∶1∶3的同分异构体的结构简式__________;
(5)写出由乙烯合成乙二醇的化学方程式________________________________。
X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:
①X元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)XY2分子空间构型为,X原子的轨道杂化方式为;QX的晶体结构与金刚石的相似,其中X原子的杂化方式为,微粒间存在的作用力是。
(2)晶体ZW的熔点比晶体XW4明显高的原因是。
(3)氧化物MO的电子总数与QX的相等,则M为______________(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是_________________________。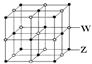
(4)ZW晶体的结构示意图如右图。已知:ρ(ZW)=2.2 g·cm-3,NA=6.02×1023mol-1,则ZW晶体中两个最近的Z离子中心间的距离为。
(15分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: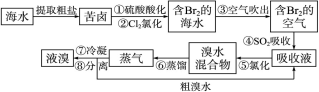
(1)溴在周期表中位于第______周期第________族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是__________________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为________________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因____________________________________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是____________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是_________________________________________。
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有。
(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)。
在实验室中,常将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。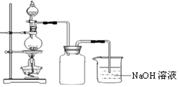
(3)写出烧瓶中发生反应的离子方程式为
(4)广口瓶的作用是
(5)为符合绿色化学的要求,某研究性学习小组进行如下
设计:将3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入18 mL 10%的H2O2,反应0.5h后,升温到60 ℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5 g。请回答:
①加热时温度不宜过高的原因是;
②本实验CuSO4·5H2O的产率为。