某烃0.5 mol A完全燃烧时,得到1.5 mol 水和67.2 L二氧化碳(标准状况)。
(1)A的结构简式为___________________。
(2)根据下列条件写出有关反应的化学方程式:
①在加入Fe粉后,A与液溴反应生成B___________________________________。
在加热和催化剂作用下A与H2反应生成C________________________________。
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数。
(1)C元素在元素周期表中的位置是_____________________,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是_________________
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是_______________
(3)写出E2D2与A2D反应的离子方程式_____________________________________。
(4)实验室配制100mL0.2mol·L—1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、量筒外还有_________________________;如果定容时仰视刻度线,则所配制溶液浓度______________0.2mol·L—1(埴“>”、“<”或“=”)。将F的单质溶于上述配制的溶液中所发生反应的离子方程式是___________________________________
人们已经研制出以丙烷为燃料的新型燃料电池,电解质为熔融酸盐,电池

(2)该电池的正极通入O2和CO2,负极通入丙烷,则正极的电极反应式为__________________________________,电池工作时CO32—移向_____________极。
(3)用该电池电解1L 1 mol·L—1的AgNO3溶 液,此电解池反应的化学方程式为_________________________________________________;当该电池消耗0.005molC3H8时,所得溶液的pH为__________(溶液体积变化忽略不计)
液,此电解池反应的化学方程式为_________________________________________________;当该电池消耗0.005molC3H8时,所得溶液的pH为__________(溶液体积变化忽略不计)
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
II.反应结束后,将乙瓶中的溶液进行如图2处理。
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是。
(2)I中,甲瓶内所盛试剂是溶液;乙瓶内发生反应的离子方程式有;I中玻璃纤维的作用是。
(3)II中,所加H2O2溶液需足量的理由是。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有;
(5)该黄铁矿中硫元素的质量分数(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数(用I、II中有关实验数据表达)
(12分)化学实验室有一试剂瓶标签严重破损,只能隐约看到一些信息,如下左图所示.
(1)该物质(M)分子式为:;
(2)A与M互为同分异构体,B无支链,B与羧酸和醇都能发生酯化反应,A在一定条件下能发生如下右图转化:


 已知:1molD能与足量的金属钠反应置换出2 g氢气,C与F互为同系物,且F是同系物中相对分子质量最小的.A能使Br2/CCl4溶液褪色,J的核磁共振氢谱图有5组峰.
已知:1molD能与足量的金属钠反应置换出2 g氢气,C与F互为同系物,且F是同系物中相对分子质量最小的.A能使Br2/CCl4溶液褪色,J的核磁共振氢谱图有5组峰.
①A的结构简式为;
②写出一个证明E中官能团的化学方程式,反应类型 ;
③写出C与D反应生成高聚物的化学方程式;
④写出与J官能团种类和数目都相同的同分异构体任意两个:、.
生物质资源是一种污染小的可再生能源。生物质的主
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的 乙醇作燃料是利用了生物质能
乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2mol CO、4molH2 CO、4molH2 |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α 2 |
α3 |
下列说法正确的是。
a. c1=c2 b. 2Q1= Q3 c. K1=K3 d. α2+ α3<100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1. 6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)=mol。
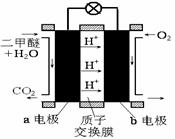
②右图为绿色电 源“直接二甲醚燃料电池”的工作原理示意图。
源“直接二甲醚燃料电池”的工作原理示意图。
b电极是极;a电极的反应式为。