利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
I、B与醋酸反应: ▲ , ▲ 反应。
II、B→C: ▲ , ▲ 反应。
(2)可用于检验A的试剂是 ▲ 。
(3)用淀粉[(C6H10O5)n]为原料制取B,若有含淀粉40%的植物果实1kg,经反应制得184g的B,则淀粉的转化率为 ▲ 。(提示:转化率=已反应的量/原有的量×100%)
某研究性学习小组在实验室合成了一种物质A。
⑴经分析,A的相对分子质量不超过100,A中C、H的质量分数分别为:w(C)=69.76%,w(H)=11.63%,且完全燃烧后产物只有CO2和H2O。则A的摩尔质量为_________。
⑵ A的核磁共振氢谱如下图所示,且A可以和金属钠反应生成H2,但不能在Cu作催化剂下被催化氧化。(提示:羟基与碳碳双键相连的结构不稳定)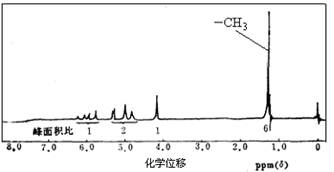
(3)请根据以上信息写出A的结构简式。
(4)A的某种同分异构体B分子中不含支链,能发生银镜反应。写出B发生银镜反应的化学方程式_______________。
“温室效应”是全球关注的环境问题之一,科学家们一直致力于CO2的“组合转化”技术研究。例如将CO2和H2以1:4或1:3的比例混合,在适当条件下反应,生成H2O的同时可分别获得重要的气态能源物质A和对植物生长有调节作用的有机物B。请回答下列问题:
(1)写出生成A的化学方程式:(不必写反应条件)
(2)某小组做了如下三组对照实验来证实有机物B对植物生长的调节作用。
实验I:集气瓶中放青色、未熟的水果,在空气中盖上玻璃片。
实验II: 集气瓶中放青色、未熟的水果,通入一定量的有机物B.
实验III:集气瓶中放青色、未熟的水果,瓶底放少量KMnO4 固体。
该三组实验中,水果成熟的先后顺序为。
(3)A分子的空间构型为,B分子中有个原子共面。
(4)试推测丙烯(CH2=CH-CH3)的结构或性质,下列说法中不正确的是(填字母)
a.丙烯分子中三个碳原子在同一直线上
b.丙烯可使酸性高锰酸钾溶液褪色
c.丙烯可使溴水褪色
d.丙烯能发生加成反应。
设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以丁烷(C4H10)为汽油代表,这个电池放电时发生的化学反应;
(2)这个电池负极发生的反应是:C4H10 + 13O2— + 26e-=4CO2+5H2O,正极发生的反应是:;固体电解质里O2-的移动方向是:;向外电路释放的电子的电极是:;
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:;
(4)汽油燃料电池最大的障碍是氧化反应不完全产生堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L层电子数是K层和M层电子数之和,C是所有短周期元素中半径最大的元素、C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应。试解答下列问题:
(1)B元素的简单离子的结构示意简图为
(2)A、D、E元素的名称分别为、、。
(3)E元素在周期表中的位置是第周期族。
(4)A B C三种元素形成的化合物的电子式为:
(5)五种元素的简单离子半径从大到小的顺序是(用元素离子符号填写)
(6)五种元素中,得电子能力最强的是,失电子能力最强的是(填元素符号)
I.现有下列物质:
1、CI2 2、Na2O2 3、NaOH 4、HCl 5、H2O26、MgF2 7、Mg3N2
(1)只有离子键构成的物质是(2)只有极性键构成的物质是
(3)只有非极性键构成的物质(4)有极性键和非极性键构成的物质是
(5)有离子键和极性键构成的物质是(6)有离子键和非极性键构成的物质是
(7)属于离子化合物的是(8)属于共价化合物的是
II.能够说明可逆反应2NO2 N2O4达到平衡状态的标志是_____________
N2O4达到平衡状态的标志是_____________
①单位时间消耗2mol NO2的同时,生成1 mol N2O4 ②恒温恒压下,混合气体的密度不变 ③NO2和N2O4的浓度之比为2∶1 ④混合气体的颜色不变 ⑤单位时间消耗4mol NO2的同时,消耗2mol N2O4