氮是地球上极为丰富的元素。2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,晶体片段结构如图所示。每个氮原子都通过3个单键与其它氮原子结合并向空间发展构成立体网状结构。这种高聚氮的N-N键的键能为160kJ/mol,而N2的键能为942kJ/mol。
⑴请根据以上信息写出固态高聚氮爆炸成氮气的热化学方程式: 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的 键比 键稳定(填“ ”“
”“ ”)。
”)。
⑶Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 
⑷2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
( )。
)。
下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
⑸继C60后,科学家又合成了N60、Si60、KnC60等,C、Si、N、K原子电负性由大到小的顺序是 > > > 。
根据所学知识填空
(1)第二周期第VIA族的元素是第几号元素?
(2)核电荷数为13的元素在周期表中的位置第周期第族
(3)原子核内有10个质子的原子
(4)核外有10个电子的+2价阳离子
(5)核外有18个电子的一1价阴离子
(6)L层为最外层,L层的电子数是K层的3倍的原子。
下面几题用“>”或“<”回答下列问题:
(7)酸性:H2CO3 H2SiO3 , H2SiO3H3PO4
(8)碱性:Ca(OH)2 Mg(OH)2,Mg(OH)2 Al(OH)3.
(9)气态氢化物稳定性:H2O H2S, H2S HCl 。
已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应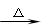
① A + H2O → B + C ② C + F → D ③ D + NaOH F + E + H2O
(1)写出它们的化学式:A、B、 D、
E、F;
(2)写出各步反应的离子方程式,并指反应①的氧化剂和还原剂物质的量比。
① 、氧化剂与还原剂物质的量比为:。
② 。
③ 。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式。
(9分)(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如下表所示:
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是 ,在周期表第 周期,第 族,其原子结构示意图 。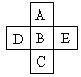
(Ⅱ)A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A ,D ,E 。
(2)A、C两种元素最高价氧化物的水化物之间反应的离子方程式 。
(共10分)下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
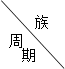 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是,氧化性最强的单质是,还原性最强的单质是;
(2)最高价氧化物的水化物中碱性最强的是,酸性最强的是,呈两性的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(4)在B、C、D、E、F、G、H中,原子半径最大的是.最小的是。
(10分)
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下: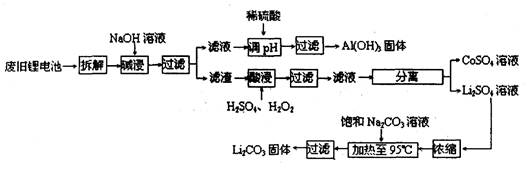
(1)上述工艺回收到的产物有
(2)Li原子的最外层电子数是,废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是___________________________________________
(3)碱浸时主要反应的化学方程式为。
(4)最后一步过滤应趁热过滤,原因是