(16分)聚苯乙烯的结构为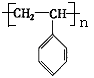 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的链节是_________________,单体是___________________;
(2)实验测得聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为_________。
(3)已知聚苯乙烯为线性结构的高分子化合物,试推测:_________(“能”与“不能”)溶于CHCl3,具有__________(填“热塑”或“热固”)性。
(8分)KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是。
(2)如何保证在700C~800C条件下进行滴定操作:。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是____________________;
②所配制KMnO4标准溶液的物质的量浓度为_______________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将____(填“偏高”或“偏低”)。
(9分)现有A、B、C、D、E、F六种无色溶液,它们可能是:CH3COONa溶液、NH4Cl溶液、NaOH溶液、CH3COOH溶液、氨水、NaCl溶液中的某一种。已知B、D两溶液呈酸性,但B溶液中水的电离程度大于D溶液中水的电离程度;A、C、F焰色反应均为黄色,F溶液呈中性,A、C溶液呈碱性,但物质的量浓度相同时,C溶液的pH值大于A溶液的pH值。试回答下列问题:
(1)在A、C、F三种溶液中,水的电离程度由大到小的顺序为(填序号)。
(2)常温下,将等物质的量浓度,等体积的B、E两溶液相混合,所得混合溶液的pH7(填“大于”或“等于”或“小于”),溶液中各离子浓度大小关系为。
(3)常温下,若C溶液中c(OH-)与D溶液中c(H+)相等,将二者等体积混合,所得混合溶液的pH7(填“大于”或“等于”或“小于”);如果将等物质的量浓度的C、D按a:b的体积比混合,混合溶液的pH恰好等于7(体积变化忽略不计),则D的电离平衡常数为(用含a、b的表达式表示)。
(4)常温下,若B溶液中c(H+)与C溶液中的c(OH-)相等,现将B、C溶液都稀释10倍,稀释后B溶液的pH值用pHB表示,C溶液的pH值用pHC表示,则pHB+pHC14(填“等于”、“大于”或“小于”)。
(B)(8分)下表中有甲、乙两组物质,可用编号回答下列问题:
| 甲 组 |
(A)C6H5OH (B)CH3COOCH3 (C)CH3=CHCOOH (D)CH3CH2Br |
| 乙 组 |
①溴水 ②FeCl3溶液 ③NaOH溶液 ④HCHO溶液 |
(1)甲组中B只能和乙组中发生反应。
(2)甲组中和乙组中②可以发生显色反应,此反应可用于两种物质的相互检验。
(3)甲组中能与乙组中所有物质发生反应。
(4)乙组中①能与甲组中发生取代反应,发生加成反应。
(5)甲组中的一种物质和乙组中的一种物质可以发生缩聚反应生成一种粉红色线型高分子化合物,该反应的方程式为。
(A)(8分)元素周期表是学习化学的工具,也为化学的进一步探索与研究提供了理论指导,化学学习者和研究者一直关注周期表的运用与发展。试回答下列问题:
(1)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是(填写元素符号)。
(2)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是(填写元素符号)。
(3)2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为。
(4)人们研究发现第一周期与第二周期一些元素的性质与同族元素性质共性很少,有人建议将氢放在VIIA,写出一种能支持该观点的化合物:;人们发现Li+溶剂化倾向很强,提出类似于氢键的“锂键”,请画出(LiF)2含锂键的结构式:。
(5)研究周期表发现存在对角线规则,处于对角线上的元素性质相似,如硼与硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式:。
【化学–选修3:物质结构与性质】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是(填元素符号,下同),电负性最大的是。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式,1 mol AB-中含有π键的数目为,黄血盐晶体中各种微粒间的作用力不涉及(填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.分子间的作用力
(3)E2+的价层电子排布图为,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③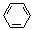 、④HCHO。其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)。
、④HCHO。其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F 两种晶体晶胞中金属原子的配位数之比为。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为。