实验室里可用甲醇等有关物质制备HCHO,关于甲醇和甲醛的沸点和水溶性见下表:
| |
沸点(℃) |
水溶性 |
| 甲醇 |
65 ℃ |
与水混溶 |
| 甲醛 |
-21 ℃ |
与水混溶 |
某校化学兴趣小组的甲、乙两位同学,在研究性学习中,运用以上信息和已有知识分别设计了二套实验室制取HCHO装置,如图甲和乙。据此请你回答下列问题:
(1)若按甲装置进行实验,则通入A试管的X应是________;B中反应的化学方程式是__________________________________________________。
(2)若按乙装置进行实验,则B管中应装入________。
(3)当实验完成时,若在C中滴加适量银氨溶液,并用水浴将C加热,发生反应的化学方程式是_________________________________________________________。
(4)在反应过程中,甲、乙两种装置中都需直接加热的仪器是________(填A、B、C)
(5)实验开始时,先打开气球D的开关,直至实验结束。气球D的作用是______________________________________________________________________。
(6)从生成甲醛的产量来看,你认为两套装置中较好的是________(填“甲”或“乙”)
工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.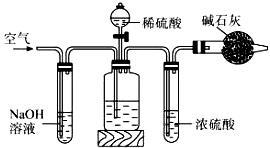
甲乙丙丁
(1)甲装置反应的离子方程式是 。
(2)乙装置反应完成后,再通数分钟空气的作用是 。
(3)若取n g样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为m g,实验结束后称得干燥管丁的总质量为w g,则Na2CO3质量分数的计算式为 。
(4)若去掉丙装置,测得的CO2质量会 (填“偏大” “偏小”或“无影响”)。
(5)有同学认为在丁后面还要再连一个跟丁一样的装置,目的是 。
实验室配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液需要________ml容量瓶。还需要烧杯、玻璃棒、量筒______仪器.
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
A 洗涤 B 量取 C 冷却 转移 D 摇匀 E 定容 F 计算
(3)若出现如下情况,对所配溶液浓度将有何影响?
加蒸馏水时不慎超过了刻度 ;定容时俯视____________未冷却______________.
Ⅰ.常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应。小明设计如下实验探究铁粉与水蒸气反应后的气体产物。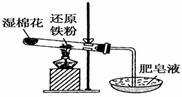
(1)试管尾部放一团湿棉花的目的是_____ 。
(2)铁与水蒸气反应的化学方程式
(3)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______________。
Ⅱ.某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答: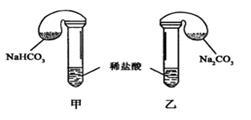
(1)各组反应开始时,_____________装置中的气球体积先变大,该装置中反应的离子方程式是_________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 |
实验现象(气球体积变化)) |
分析原因 |
|
| 第 ① 组 |
42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 |
甲中气球与乙中 气球的体积相等 |
甲、乙盐酸均过量 n(NaHCO3)="n" (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 |
42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率  (KMnO4) = 。
(KMnO4) = 。
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中
(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中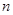 (Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。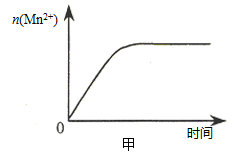
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
|
 |
A.KMnO4B.H2C2O4C.K2SO4D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
“碘钟”实验中,3I-+S2O82-===I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/(mol·L-1) |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/(mol·L-1) |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是_________________________________________________。
(2)显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t3的范围为____(填字母)。
A.<22.0 s
B.22.0~44.0 s
C.>44.0 s
D.数据不足,无法判断