“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题: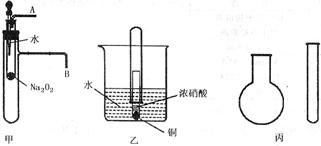
实验一:图甲是对课本有关Na2O2某性质的两个实验的改进。
⑴将胶头滴管中的水滴入小试管,然后,在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是___________________,_________________。
⑵写出甲中反应的离子方程式_________________________________。
实验二:图乙是对铜和浓硝酸反应实验的改进。
⑶写出铜和浓硝酸反应的离子方程式为_________________________________。
⑷反应开始后,能观察到的现象是__________________________________,随后气体颜色逐渐变浅;大试管中液面上升。
⑸与普通演示实验相比,此实验除操作方便之外,还有_____________等优点。
实验三、现有下列药品:A.氯化铵固体,B.氢 氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
⑹此实验制备氨气选用的最合适药品是__________(填序号)。
某学生做浓硫酸性质的实验:在一个白色的点滴板的孔穴中分别放入小纸片、少量CuSO4·5H2O。然后如图所示,分别滴入几滴浓硫酸或稀硫酸,观察现象。回答下列问题: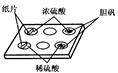
(1)浓硫酸滴入小纸片上,小纸片变 _________(填实验现象),说明浓硫酸具有_________性。
(2)稀硫酸滴入CuSO4·5H2O中,胆矾_________________(填实验现象);浓硫酸滴入CuSO4·5H2O中,胆矾_______________(填实验现象),说明浓硫酸具有_______性。
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。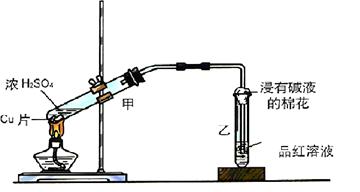
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成____________;
写出甲装置中发生的主要反应的化学方程式_______________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是。
(3)实验完毕后,取少量乙试管中溶液于试管中加热,现象是;原因是。
(1)下图所示是实验室中制取气体的一种简易装置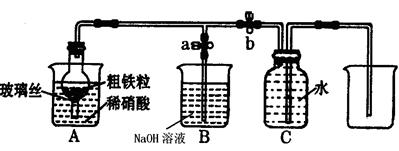
①.甲同学用下列方法检验发生装置的气密性,请问能否达到目的(填能或否)
关闭止水夹a和b,从A处烧杯中加入水,使干燥管与烧杯中液面形成液面差,一段时间后,液面差没有变化,说明气密性良好。
②.实验室利用上图所示发生装置可以制取下列气体。
| A.Cl2 | B.CO2 | C.NH3 | D.SO2 |
(2)乙同学利用该图所示装置,用粗铁粒与3mol·L-1硝酸反应制取NO气体。请回答有关问题。
①NO气体能用排水法收集,而不能用排空气法收集的原因是。
②制取NO时,向A杯中加入稀硝酸,同时打开止水夹a,关闭止水夹b,A装置的干燥管中观察到气体的颜色的变化为。
B装置烧杯中NaOH溶液的作用是。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
③将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反
应后Fe和HNO3均无剩余,则反应中转移电子的物质的量为mol(用含b的代数式示)。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 |
实验现象 |
| 1.用砂纸擦后的镁带与热水反应,再向反应后溶液中滴加酚酞 |
A.浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| 2.向Na2S溶液中滴加新制的氯水 |
B.产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞试液的冷水反应 |
C.反应不十分强烈,产生的气体可以在空气中燃烧 |
| 4.镁带与2mol.L-1的盐酸反应 |
D.剧烈反应,产生可燃性气体 |
| 5.铝条与2 mol.L-1的盐酸反应 |
E.生成白色胶状沉淀,既而沉淀消失 |
| 6.向AlCl3溶液滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:;
(2)实验用品:仪器:①②③④⑤镊子⑥小刀⑦玻璃片⑧砂纸 ⑨试管夹
药品:钠、镁带、铝条、2 mol.L-1的盐酸、新制的氯水、Na2S溶液、 AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
123456(用A-F表示);
写出③的离子方程式;
(4)实验结论:;
已知:溴苯的熔点为‒30.8℃,沸点156℃。实验室用苯和液溴制取溴苯的装置如图: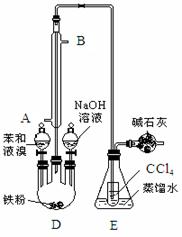
(1)写出制取溴苯的化学方程式;
(2)冷凝管中(填“A”或“B”)通过橡皮管与自来水龙头连接;
(3)制取溴苯反应容器D的名称;
(4)冷凝管的作用;
(5)E中小试管内CCl4作用 ;
(6)用实验证明制取溴苯的反应是取代反应还需添加的试剂是;
(7)溴苯中溶有溴而显褐色,除去溴苯中溴可加入溶液,振荡,再通过(填分离方法)分离提纯;
(8)苯与溴还可能发生副反应生成对二溴苯(沸点220℃)和邻二溴苯(沸点224℃),在(7)中得到的溴苯中还含有二溴苯,可通过(填分离方法)提纯得到溴苯,为了受热均匀和易于控制温度,可采用(填“水浴”或“油浴”)加热。