(1)有两瓶CCl4和水都是无色液体,只用试管,不用任何其它试剂,如何鉴别?简要写出实验方案
;
(2)有一小块外表不规则且质地坚实的碳酸钙,设计一个实验方案用以测定这种碳酸钙的密度,提供的仪器有:托盘天平,100ml 量筒,要用到的试剂可任意取用
.
为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出合适的实验操作方法分离,将标号填在后面的答案栏内。
| Ⅰ除杂实验 |
Ⅱ试剂 |
Ⅲ操作方法 |
答案 |
||||||
| Ⅰ |
Ⅱ |
Ⅲ |
|||||||
| ①苯(苯酚) |
|
a.蒸馏 b.分液 c.盐析 d.过滤 |
① |
||||||
| ②乙醇(水) |
② |
||||||||
| ③肥皂(甘油、水) |
③ |
||||||||
| ④乙酸乙酯(乙酸) |
④ |
(22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为;1mol O22+中含有的 键数目为。
键数目为。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为。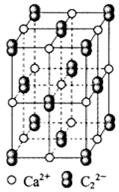
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是;甲醛分子中碳原子的轨道杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。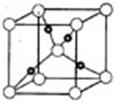
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。
水的电离平衡曲线如下图所示。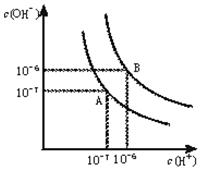
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为。
钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、 BaSO3、 Ba(FeO2)2等]。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是、。
(3)该厂结合本厂实际,选用的X为(填化学式);中和Ⅰ使溶液中(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a; X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: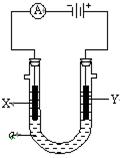
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。在X极附近观察到的现象是。
② Y电极上的电极反应式为,
检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)