黄铁矿主要成分是。某硫酸厂在进行黄铁矿成分测定时,取0.1000样品在空气中充分灼烧,将生成的气体与足量溶液完全反应后,用浓度为0.02000 的标准溶液滴定至终点,消耗溶液25.00 。
已知:
(1)样品中的质量分数是(假设杂质不参加反应)
(2)若灼烧6 产生的全部转化为气体时放出9.83 热量,产生的与水全部化合生成,放出13.03热量,写出气体转化为的热化学方程式:
(3)煅烧10上述黄铁矿,理论上产生的体积(标准状况)为,制得98%的 ,全部转化为时放出的热量是。
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有(填化学式),加入CO3(PO4)2的目的是。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段:;
②BC段。
Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:RX+Mg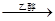 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇: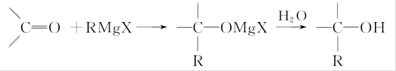
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下:
请按要求填空:
(1)用系统命名法对物质B进行命名:;
(2)在I-J过程中所加入的二元酸的结构简式为:;
(3)反应①~⑧中属于取代反应的有个;属于消去反应的有个.
| A.1个 | B.2个 | C.3个 | D.4个 |
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B→D;
I→J;
(5)写出一种满足以下条件的D的同分异构体的结构简式。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第七列元素 |
| F是第29号元素 |
(1)A的基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
(2)E2+的基态核外电子排布式为。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是。由B、C二种元素组成的分子与AC2互为等电子体的分子的结构式为。(用化学式表示)
(4)BD3中心原子的杂化方式为,其分子空间构型为。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为9.00g/cm3,晶胞中该原子的配位数为;F的原子半径是cm;(阿伏加德罗常数为NA,要求列式计算)。
(15分)2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2为了加快该反应的反应速率,可采取的措施是。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O ;
3CrO42-+4H+= Cr3O102-+2H2O ① 往混合溶液甲中加入硫酸必须适量的原因是。
② 混合溶液乙中溶质的化学式是。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O  2CrO42-+2H+,请写出该平衡的平衡常数表达式K=,若继续加水稀释,平衡将移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K=,若继续加水稀释,平衡将移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5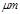 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH=。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g) 2NO(g)△H
2NO(g)△H 0
0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K=。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H 0,判断该设想能否实现并简述其依据:。
0,判断该设想能否实现并简述其依据:。