有机物W(C3H6O3)能与NaHCO3反应,分子中含有四种活动性不同的氢原子,个数比为3∶1∶1∶1。
(1)W的结构简式是 。
(2)W的工业合成路线如下图所示:
已知:Ⅰ.A、B、C、D与W分子中含有相同碳原子数;
Ⅱ.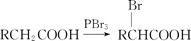
①写出A的结构简式是 ;
②B与新制Cu(OH)2反应的化学方程式是 ;
③D在NaOH水溶液中反应的化学方程式是 ;
④C的同分异构体中,能够与Ag(NH3)2OH溶液反应的有 种。
(3)工业上也可以用下图所示合成路线生产W:
已知:
请在合成路线框图中填入相应有机物的结构简式。
(4)W在一定条件下,反应生成丙交酯(C6H8O4)(含六元环结构),该反应的化学方程式是(有机物写结构简式) 。
丙交酯在一定条件下聚合生成聚丙交酯(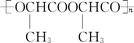 ),聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是
),聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是
。
(8分)(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第___族。
|
|
|
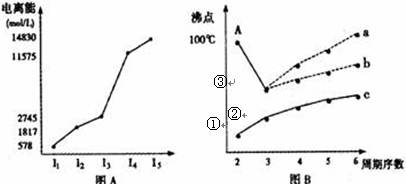


A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol―1):
| I1 |
I2 |
I3 |
I4 |
|
| C |
738 |
1451 |
7733 |
10540 |
| D |
577 |
1817 |
2745 |
11578 |
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显价,D显价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含___个σ键,___个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是______________________________
| 单键 |
双键 |
叁键 |
||
| AB |
键能(kJ·mol―1) |
357.7 |
798.9 |
1071.9 |
| 甲 |
键能(kJ·mol―1) |
154.8 |
418.4 |
941.7 |
(4)E能与AB形成配合物,其中E提供______________,AB提供________________。
(5)下列晶胞中,阳离子与阴离子的个数为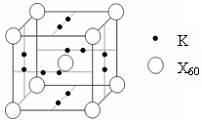
有A、B、C、D、E、F六种前四周期元素,原子序数A<B<C<D<E<F。A原子只有一个电子层且只含1个电子;B、C两元素的基态原子具有相同能级,且I1(B)>I1(C),其中基态B原子的2p轨道上有3个未成对电子;D原子s电子数比p电子数少4;E原子的3p轨道上得到1个电子后不能再容纳外来电子;F为周期表前四周期中电负性最小的元素
(1)写出下列元素的元素符号:下
C___________ F_____________
(2)写出E元素原子的价电子轨道表示式___________________
(3)B、C两元素原子的电负性大小: B_______C(填“<”或“>”)
(4)A2C与A2D的熔沸点:A2C_______A2D (填“<”或“>”)
(5)A、C两元素按原子个数比为1:1结合成的化合物化学式为_____________
(6)BA3的中心原子杂化方式为______杂化,该化合物的空间构型为_____________.
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
下列五种物质中,①H2O ②CO2③Na2O2 ④NaOH ⑤NaBr,只存在共价键的是__________,只存在离子键的是__________,既存在离子键又存在共价键的是_________,含有极性键的是__________,是非极性分子的是________。(填编号)下