有关元素X、Y、Z、W的信息如下:
| 元素 |
信息 |
| X |
所在主族序数与所在周期序数之差为4 |
| Y |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W |
基态原子核外5个能级上有电子,且最后的能级上只有1个电子 |
请回答下列问题:
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为
(2)铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式
(3)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为 ,Z3+离子的电子排布式为 ,它有 个未成对电子。
(4)以上述所得WX3溶液为原料制取无水WX3,先制得WX3·6H2O晶体,主要操作包括 ,在 条件下加热WX3·6H2O晶体,能进一步制取无水WX3,其原因是(结合离子方程式简要说明) 。
有A、B、C、D四个反应:
| 反应 |
A |
B |
C |
D |
| ΔH/(kJ·mol-1) |
10.5 |
1.80 |
-126 |
-11.7 |
| ΔS/(J·mol-1·K-1) |
30.0 |
-113.0 |
84.0 |
-105.0 |
则在任何温度下都能自发进行的反应是 ;任何温度下都不能自发进行的反应是 ;另两个反应中,在温度高于 ℃时可自发进行的反应是 ;在温度低于 ℃时可自发进行的反应是 。
氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2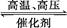 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式 。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知该反应的ΔS="-198.2" J·K-1·mol-1。则上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
(1)科学家根据体系存在着力图使自身能量趋于 和由 变为 的自然现象,提出了互相关联的 判据和 判据,为最终解决“反应进行的方向”这一问题提供了必要的依据。
(2)在密闭条件下,体系有有序自发地转变为无序的倾向,因为与有序体系相比,无序体系更加稳定,科学家把这种因素称作 。
(3)判断下列过程熵变的正负(填“>0”或“<0”):
①溶解少量蔗糖于水中,ΔS ;
②纯碳和氧气反应生成CO(g),ΔS ;
③液态水蒸发变成水蒸气,ΔS ;
④CaCO3(s)加热分解生成CaO(s)和CO2(g),ΔS 。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
Fe3+和I-在水溶液中的反应为:2I-+2Fe3+ 2Fe2++I2(水溶液)。
2Fe2++I2(水溶液)。
该反应的平衡常数K的表达式为K= 。当上述反应达到平衡状态后,加入CCl4萃取I2,且温度不变,上述平衡 移动(填“向右”“向左”或“不”)。