已知:
 |

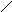

 ① + CH3Br
① + CH3Br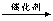 +HBr ;②C物质苯环上一卤代物只有两种。
+HBr ;②C物质苯环上一卤代物只有两种。
 |
 根据上述转化关系,回答问题:
根据上述转化关系,回答问题:
(1)写出B物质的名称 ;D物质的结构简式 。
(2)写出反应②的类型 ;反应⑤的条件 。
(3)写出反应⑥的化学方程式:
(4)写出E和D反应的化学方程式:
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式: 。
(6)分子中具有苯环,苯环上含有两个取代基,且能与NaHCO3溶液反应的E的同分异构体有_______种(不包含E)。
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.lmol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
硅单质及其化合物应用范围很广。
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
Ⅰ.高温下用碳还原二氧化硅制得粗硅
Ⅱ.粗硅与干燥的氯气在450℃~500℃反应制得SiCl4
Ⅲ.S iCl4液体经精馏提纯后与过量H2在1100℃~1200℃反应制得纯硅
iCl4液体经精馏提纯后与过量H2在1100℃~1200℃反应制得纯硅
已知SiCl4沸点为57.6℃,能与H2O强烈反应。1molH2与SiCl4气体完全反应吸收的热量为120.2kJ。请回答下列问题:
①第Ⅰ步制备粗硅的化学反应方程式为,第Ⅲ步反应的热化学方程式是
 。
。
②整个制备纯硅过程必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是;H2还原SiCl4过程中若混O2,可能引起的后果是。
(2)二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO244kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x=。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
NaR |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H 2O +2NaClO===Na2CO3+2HClO 2O +2NaClO===Na2CO3+2HClO |
| B.CO2+H2O +NaClO===NaHCO3+HClO |
C.CO2 +H2O +NaR NaHCO3+HR NaHCO3+HR |
D.CO2 +H2O +2NaR Na2CO3+2HR Na2CO3+2HR |
E.Na2CO3+HR NaHCO3+NaR
NaHCO3+NaR
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________( 填数值);pH最大的是_________(填编号)。
填数值);pH最大的是_________(填编号)。
①HR②CH3COOH③HCN④HClO⑤H2SO4⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:______________________;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是_______________________,
请写出反应的离子方程式:____________________________________________。
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式)。
(2)写出并配平该反应的化学方程式
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 。
21.(6分)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为mol。
(2)该气体在标准状况下的体积为L。
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为mol/L