钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。V2O5是接触法制硫酸的催化剂。
(1) 一定条件下,SO2与空气反应t min后,SO2和SO3 物质的量浓度分别为a mol/L、b mol·L-1,则SO2起始物质的量浓度为_________mol/L ;生成SO3的化学反应速率为_____________________。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的,其装置原理如下图: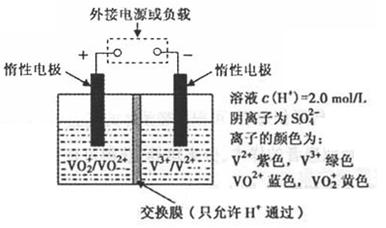
①当左槽溶液逐渐由黄变蓝,其电极反应式为_______________________________。
②充电过程中,右槽溶液颜色逐渐由__________色变为_______色。
③放电过程中氢离子的作用是________________和___________________________;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为______________。
有一种不饱和醇,其结构简式为CH2=CHCH2OH,请回答下列问题:
(1)写出该化合物中官能团的名称__________。
(2)试推测该化合物可能发生的反应为__________(填序号)。
①与酸性高锰酸钾溶液反应 ②与溴水反应 ③与H2反应
④与Na反应⑤燃烧反应 ⑥催化氧化反应
下列各物质互为同位素的是;互为同素异形体的是;互为同系物的是;互为同分异构体的是_____________;互为同一物质的是
| A.CH2=CH2和CH2=CH—CH=CH2 |
| B.C4H8和C6H12 |
| C.O2和O3 |
D. |
E. 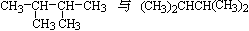
F. C2H6和C4H10G.16O 、18O
H. 金刚石和石墨
I. CH3(CH2)3CH3和(CH3)2CHCH2CH3
J.CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5
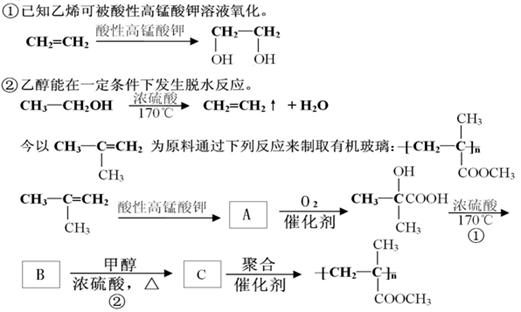
(1)请写出上面方框内的有机物的结构简式
A.B.C.
(2)写出反应①和反应②的化学方程式及反应类型:
反应①:;反应类型
反应②:;反应类型
(3)写出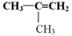 的链状结构的同分异构体中两种物质的结构简式;;
的链状结构的同分异构体中两种物质的结构简式;;
某物质A的产量可以用来衡量一个国家的石油化工发展水平。其与水加成的产物B是一种常用的有机溶剂,在生活中有重要的应用。
(1) A的电子式为________,B的分子式为________。
若用B与O2制成燃料电池,并以稀硫酸溶液为电解质溶液,回答(2)-(5)题:
(2)负极上的电极反应式为_______________________________________。
(3)消耗标准状况下的5.6 L O2时,有__________mol电子发生转移。
(4)开始放电时,正极附近溶液的pH__________(填“增大”、“减小”或“不变”);
(5)溶液中H+由___________区向__________区移动(填“正极”或“负极”)。
现有10种元素的性质、数据如下表所列,它们均为短周期元素。回答下列问题:
| A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
| 原子半径(10-9m) |
0.074 |
0.160 |
0.152 |
0.110 |
0.099 |
0.186 |
0.075 |
0.082 |
0.102 |
0.037 |
| 最高或最低 化合价 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
+6[ |
+1 |
|
| -2 |
-3 |
-1 |
-3 |
-2 |
(1)H的元素符号是; B在元素周期表中的位置是(周期、族)
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是。
(3)化合物F2A2的电子式是:,构成该物质的化学键类型为________________(填“离子键、极性键或非极性键”)
当F2A2与J2A的反应中有3.01×1023个电子转移时,参加反应的F2A2的质量是g。
(4)用电子式表示J2A的形成过程:;