一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
根据题意完成下列各题:
⑴反应达到平衡时,平衡常数表达式K=
升高温度,K值 (填“增大”“减小”或“不变”)。
⑵5000C ,从反应开始到平衡,氢气的平均反应速率v(H2)= (用nB、 tB 表示)
⑶在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
⑷可逆反应:CO(g)+ 2H2(g) CH3OH(g)在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g)在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
⑸据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
为了防止或减少机动车尾气和燃煤产生的烟气对空气的污染,人们采取了很多措施。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H<0,
2CO2(g)+ N2(g)△H<0,
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)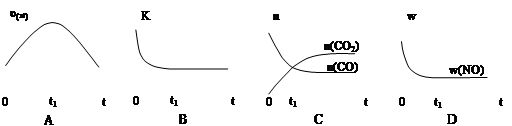
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol①
2NO2(g) N2O4(g)ΔH=-56.9 kJ/mol②
N2O4(g)ΔH=-56.9 kJ/mol②
H2O(g) = H2O(l)ΔH=-44.0 kJ/mol③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过催化剂,通过测量逸出气体中氮氧化物含量,从而可确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。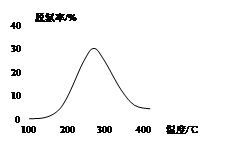
①该反应的△H0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP=。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨I为电池的极。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为。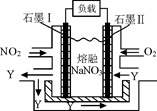
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1︰1)的质量为g。
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式: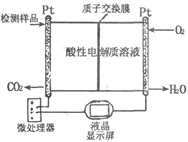
负极,正极。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为。
设计新型燃料电池是本世纪最富有挑战性的课题之一。
(1)有人制造了一种燃料电池,一个电极通入O2(含有少量CO2),另一个电极通入CH4,电池的电解质是熔融的K2CO3。该电池的负极反应式为____________________________,电池工作时,电解质里的CO(向________极移动(填“正”或“负”)。
(2)某科研小组依据甲醇燃烧的反应原理,设计如图10-3所示的原电池装置。该电池的负极反应式为________________________________________________,用该电池电解CuCl2溶液,当产生33.6 L Cl2(标准状况下)时,消耗甲醇的质量为________g。
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
H2O/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
碘在科研与生活中有重要作用,某兴趣小组用0.50 mol·L—1KI、0.2%淀粉溶液、0.20 mol·L—1K2S2O8、0.10 mol·L—1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82—+ 2I— =" 2" SO42— + I2(慢) I2 + 2 S2O32— = 2I— + S4O62—(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为:n(S2O32—):n(S2O82—) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 |
体积V/ml |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx = ml,理由是 。
(3)已知某条件下,浓度c(S2O82—)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)~反应时间t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起捕器电源—锂碘电池的材料,该电池反应为:
2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s)ΔH2
则电池反应的ΔH = ;碘电极作为该电池的 极。