为了防止或减少机动车尾气和燃煤产生的烟气对空气的污染,人们采取了很多措施。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0,
2CO2(g)+ N2(g) △H<0,
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)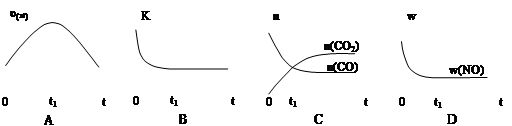
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) ΔH=-56.9 kJ/mol ②
N2O4(g) ΔH=-56.9 kJ/mol ②
H2O(g) = H2O(l) ΔH=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过催化剂,通过测量逸出气体中氮氧化物含量,从而可确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。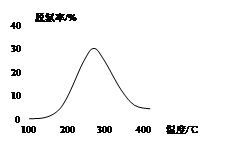
①该反应的△H 0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP= 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨I为电池的 极。 该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。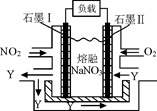
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1︰1)的质量为 g。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。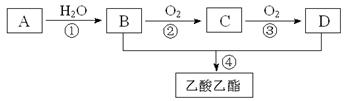
回答下列问题:
(1)写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型:①,②,④。
(4)写出下列反应的化学方程式:
①;
②;
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质。它们之间的转化关系如下图所示:
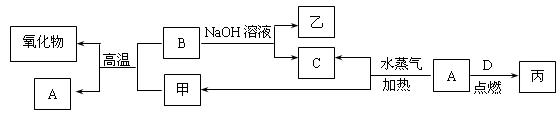

 请回答下列问题:
请回答下列问题: (1)B与甲反应的化学方程式是。
(1)B与甲反应的化学方程式是。 (2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?(填“是”或“否”)。
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?(填“是”或“否”)。



 (3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是 。
。 (4)写出A与水蒸气反应生成C和甲的化学方程式。
(4)写出A与水蒸气反应生成C和甲的化学方程式。 (5)将A、B两种金属按一定的质量比组成混合物。
(5)将A、B两种金属按一定的质量比组成混合物。 ①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是,混合物中B的物质的量为mol(用含字母的分数式表示)。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是,混合物中B的物质的量为mol(用含字母的分数式表示)。 ②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为mol,混合物中A的质量为g(用含字母的分数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为mol,混合物中A的质量为g(用含字母的分数式表示)。 ③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为。

(1)能源是当今社会发展的三大支柱之一。天然气是一种高效、低耗、污染小的清洁能源,主要成分为甲烷,甲烷燃烧的化学方程式为: ;
; 标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为mol。
标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为mol。

 s
s
 在如图构想的物质循环中太阳能最终转化为能。
在如图构想的物质循环中太阳能最终转化为能。
 (2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀 的主要原因,某同学按右图进行钢铁腐蚀的模拟,则
的主要原因,某同学按右图进行钢铁腐蚀的模拟,则
负极的电
 极反应式为,
极反应式为, 正极的电极反应式为。
正极的电极反应式为。 【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】
【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】 (3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:

 操作①的名称是;反应②的离子方程式是,下述物质中不可做试剂③的是。
操作①的名称是;反应②的离子方程式是,下述物质中不可做试剂③的是。
| A.乙醇 | B.苯 | C.乙酸 | D.四氯化碳 |
元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
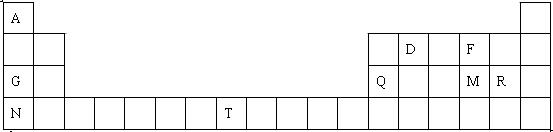
(1)表中T的元素符号为,金属性最强的元素是(填元素符号)。 (2)元素的非金属性:MR(填“>”或“<”)。
(2)元素的非金属性:MR(填“>”或“<”)。 (3)R的最高价氧化物对应水化物的化学式是。
(3)R的最高价氧化物对应水化物的化学式是。 (4)F、G两元素形成的淡黄色固体物质的电子式为,该物质含有的化学键的类型是。
(4)F、G两元素形成的淡黄色固体物质的电子式为,该物质含有的化学键的类型是。 (5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。 (6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为。
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为。 (7)A与D形成分子的空间结构可能是(填序号)。
(7)A与D形成分子的空间结构可能是(填序号)。
工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室 用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)  4CO(g) + BaS(s)△H1 =" 571.2" kJ·mol-1①
4CO(g) + BaS(s)△H1 =" 571.2" kJ·mol-1①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s)△H2=" 226.2" kJ·mol-1②
2CO2(g) + BaS(s)△H2=" 226.2" kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
(2)反应C(s) + CO2(g)  2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
①下列措施中,有利于降低大气中CO2浓度 的有:。(填字母)
的有:。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6 b.CO2 + 3H2
C6H12O6 b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是,原子利用率最高的是。