(1)除去KCl溶液中的K2SO4,依次加入的试剂是 (填化学式),按实验操作顺序发生的第一个反应的化学方程式为 。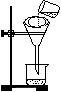
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为:
 |
回答下列问题:
①操作A所需的仪器有 ;
②操作B的名称是 ;
③过滤步骤的装置和操作如图所示,指出图中的两处错误:
;
。
“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请回答下列问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
①写出步骤I的化学方程式:__________________________________________________。
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是_________________。
③下列有关硅材料的说法正确的是 ( )
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
④在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是_______(填字母)。
A.高温结构陶瓷B.生物陶瓷C.导电陶瓷
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。下列物质中不属于合金的是( )
A.钢铁B.青铜C.硬铝D.水银
(3)高分子材料。它可以分成无机高分子材料和有机高分子材料。[Al Fe (OH)n Cl6-n]m属于无机高分子材料,是一种新型高效净水剂,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为______;
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66g白色沉淀。过滤,在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20g固体。
①该磁性粉末中氧元素的质量分数为________;
②该材料的化学式为___________________。
H2O2是重要的化学试剂,在实验室和生产实际中应用广泛。
(1)H2O2不稳定,其生产过程要严格避免混入Fe2+和Fe3+,否则会发生如下两个反应,加快其分解,且Fe2+和Fe3+各自的量保持不变。
①2Fe2+ + H2O2 + 2H+=2Fe3+ + 2H2O
②(填离子方程式)。
(2)H2O2的水溶液显弱酸性,写出一个用盐酸制取H2O2的化学方程式__________________。
(3)H2O2在使用中通常不会带来污染。
①工业上利用Cl2 + H2O2 =" 2HCl" + O2除氯,在此反应中被氧化的物质是______________。
②消除某废液中的氰化物(含CN-),完成下列反应:
CN- + H2O2 + H2O=____________ + NH3↑
(4)实验室常用酸性KMnO4溶液测定H2O2的浓度。
取10.00 mL H2O2溶液样品(密度近似为1g/mL)于锥形瓶中,加水到50.00 mL,当滴入0.10 mol/L KMnO4 溶液40.00 mL后,恰好完全反应。则原样品中H2O2的质量分数是_______________。
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。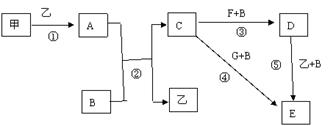
请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_______________________________________________________,
甲与B反应的离子方程式 _____________________________________________________。
在实验室将C溶液滴入F溶液中,观察到的现象是___________________________________。
在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________________________。
已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确,请通过计算对比数据加以说明____________________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理。
含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。
回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是。
| A.S2- | B.S | C.SO32- | D.SO42- |
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。
所选试剂是____________,该反应的离子方程式为:。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面,则发生了钝化;若铁棒表面,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式,最佳途径是__________(填序号),理由是。
Cl2是一种重要的化工原料,下图是一些含氯产品。
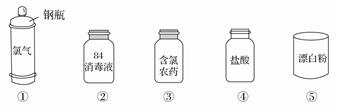
(1)①中钢瓶上应贴的标签为_____________。
A.腐蚀品 B.爆炸品C.有毒品 D.易燃品
(2)下列有关漂白粉和漂白液的说法正确的是___________。
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉
D. 漂白液的有效成分是Na2O2
(3)工业上利用Cl2制盐酸,其化学方程式为____________________________。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是_____________。
A.硝酸银溶液B.酚酞溶液C.碳酸钠溶液 D.紫色石蕊溶液
(4)将8.7 g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是_________L;被氧化的HCl的质量是_____________g。
(5)下图是实验室用KMnO4与浓盐酸制取适量氯气的简易装置。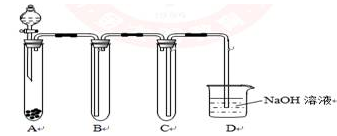
装置B、C、D的作用分别是:
B___________________________________________________;
C___________________________________________________; D___________________________________________________。