碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) △H2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)若用石墨做电极电解饱和食盐水,则电解反应的离子方程式为: ;
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为1L的恒容密闭容器中,进行反应
 CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
CO2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
2 |
4 |
0.8 |
3.2 |
2 |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
化合物M广泛应用于化学合成行业。其两种合成路线如下图所示。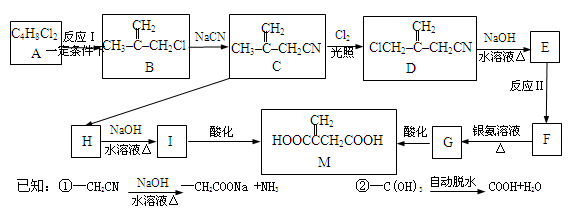
完成下列填空:
(1)反应Ⅰ的反应类型是反应;反应Ⅱ的反应条件是。
(2)写出结构简式。A;H。
(3)写出D→E的化学反应方程式。
(4)与M有相同的官能团的M的同分异构体共有种(不考虑顺反异构)。
(5)用于纸张涂膜等的S.B.R乳胶,是由M、苯乙烯、1,3-丁二烯共聚生成,写出该乳胶的结构简式
(不考虑单体比例)。
(6)实验室用2%的硝酸银溶液和2%的氨水配制银氨溶液。简述银氨溶液的配制过程。
DEHP是一种应用广泛的塑料增塑剂。DEHP有如下的转化关系。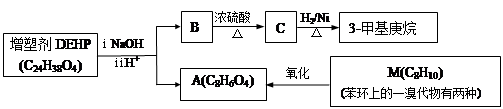
完成下列填空:
(1)M的结构简式是。A分子中所含官能团的名称是。
(2)B分子中有1个碳原子连接的烷基是乙基和正丁基。B的结构简式是。
(3)化合物C的名称是。
(4)F是A的一种同分异构体,具有下列特征:a.是苯的邻位二取代物 b.遇氯化铁溶液显紫色 c.能与碳酸氢钠溶液反应。写出F与足量碳酸氢钠溶液反应的化学方程式。
Cl2合成有机物时会产生副产物HC1。4HCl+O2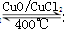 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
完成下列填空:
(1)该反应平衡常数的表达式K=;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为mol/L∙ min。
(2)若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是。
a.v (HCl)="2" v(Cl2)
b.4v正(HCl)= v逆(O2)
c.又加入1mol O2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
(3)下图是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1 ] 下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是。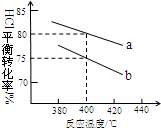
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(4)投料比为4:1、温度为400℃时,平衡混合物中Cl2的物质的量分数是。
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向。
(3)在20.00mL的0.1mol/LVO2+溶液中,加入0.195g锌粉,恰好完成反应,则还原产物可能是。
a.Vb.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+。
镁铝尖晶石(MgAl2O4)常做耐火材料。共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧。完成下列填空:
(1)为使Mg2+、Al3+同时生成沉淀,应该把(填“a”或“b”)滴入另一溶液中。
(2)将上述制备反应中部分元素的简单离子:Al3+、Cl–、Mg2+、H+、O2–按半径由大到小的顺序排列
(用离子符号表示)。
(3)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是,属于难溶物的电离方程式。
(4)不能说明氧元素的非金属性比氮元素强的事实是_________。
a. H2O比NH3稳定b. 共用电子对偏向:H-O>H-N
c. 沸点:H2O>NH3 d. NO中氮是+2价,氧是-2价