随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
1.00 |
0 |
0 |
||
| 10 |
0.58 |
0.21 |
0.21 |
||
| 20 |
0.40 |
0.30 |
0.30 |
||
| 30 |
0.40 |
0.30 |
0.30 |
||
| 40 |
0.32 |
0.34 |
0.17 |
||
| 50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
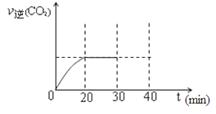
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在右图中画出30min至40min的变化曲线。
请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为,质量之比为。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol—1,则:
①该气体的物质的量为mol。
②该气体在标准状况下的体积为L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为mol·L—1。
(4)将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是mol·L—1。
(5)用等体积的0.1 mol·L—1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为。
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键B.共价键C.金属键D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是______(填元素符号)。
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2OB.CH4C.HF D.CO(NH2)2
硫化钠是重要的工业原料。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。
①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
下表是元素周期表的一部分,其中A—G分别代表一种元素。
请根据表中所列元素,回答下列问题:
(1)所列元素中第一电离能最小的是(填元素符号);D元素原子核外有种不同运动状态的电子;基态原子的价电子层中,未成对电子数最多的元素是(填元素符号)。
(2)AC2分子的空间构型是,该分子中A原子的杂化方式为。
(3)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物的溶解度,原因是。
(4)基态G2+的核外电子排布式是,乙二胺(结构简式为H2N—CH2一CH2—NH2)分子中的碳原子的杂化方式为,G2+与乙二胺可形成配离子 该配离子中含有的化学键类型有(填字母编号)。
该配离子中含有的化学键类型有(填字母编号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)化合物EF[F(AB)6]是一种常见的蓝笆晶体,其中的AB—与B2为等电子体,则、AB—的电子式为。下图为该蓝色晶体晶胞的 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为个。
下图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题。
②
③几种物质不同温度下的溶解度。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:
。
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是。
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是。