可用图示装置制取少量乙酸乙酯。请填空:
(1)为防止a中的液体在实验时发生暴沸,在加热前应采取
的措施是 。试管b中加有
溶液,其作用是 。
(2)实验中加热试管a的目的是:
① ;
② 。
(3)图中一个明显的错误是 。
下表是常温下,浓度为0.01 mol·L-1的NaOH溶液与几种酸或盐混合后的情况: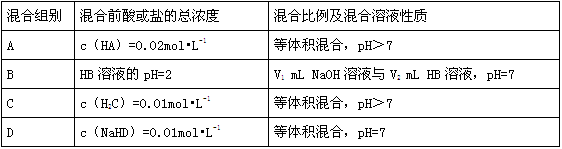
回答下列问题:
(1)A组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=______ mol•L-1(填具体数字)。
(2)由B组混合液pH=7可推知,V1____V2。
(3)C组混合液中,pH>7的原因是________。
(4)0.01mol•L-1NaHD溶液中,水的电离度(已电离的量与初始总量之比)=________。
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是________。
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药物,右图是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用最灵敏的检验试剂为_______(填试剂的名称)。
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为:_____________________________。
(3)称量上述含铁元素质量分数为20.00%的“速力菲”20.00g,将其全部溶于稀硫酸中,配制成1 000.00mL溶液.取出20.00mL,用0.01mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如下图所示。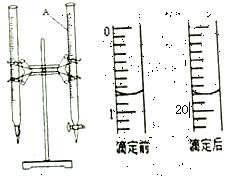
①仪器A的名称是________:由上图可知消耗KMnO4溶液体积为_________ mL;
②滴定终点观察到的现象为______________________________;
③以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是________。
| A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出 |
| B.滴定前俯视,滴定后仰视(标准液) |
| C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁 |
| D.未用标准KMnO4溶液润洗滴定管 |
④该药品可以服用吗?_____(填“可以”或“不可以”)
(1)在一定条件,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向______(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是______(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如右图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)______v(b)(填“>”、“<”或“=”);
(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH-)的比值为_________________;
(4)下列事实一定能说明HF是弱酸的是__________;
①常温下NaF溶液的pH大于7②常温下0.1mol/L的HF溶液pH=2.3
③HF能与Na2CO3溶液反应,产生CO2气体④1mol/L的HF水溶液能使紫色石蕊试液变红
在一个氧化还原反应中,氧化剂和还原剂转移的电子数应该相等。已知Na2SO3是一个具有还原性的盐。KMnO4是一个具有强氧化性的盐,易被还原为无色的Mn2+。两种物质均广泛用于工业合成上,回答下列问题。
(1)将Na2SO3溶液加入盛有下列溶液的试管中,试管内产生明显现象的是________
a.BaCl2溶液 b.淀粉碘化钾溶液 c.高锰酸钾溶液 d.NaOH溶液
(2)为了增强KMnO4溶液的酸性,实验室常在该溶液中加入一种酸,该酸是______
(3)KMnO4和亚铁离子在酸性条件下可得到Fe3+,且2Fe3++2I—=2Fe2++I2。在含1molKMnO4的溶液中加入2molFeI2固体,所得产物n(I2):n(Fe3+)为________
(4)工业合成中所用的Na2SO3固体中常含有Na2SO4和Na2CO3杂质,为测定固体中Na2SO3的含量,某兴趣小组设计以下三种方案,可行的一种是_______(填字母),利用该可行方案,所测的Na2SO3的质量分数为____________________。
a 方案:称量固体30g,溶于足量稀硝酸中,完全反应后,加入过量BaCl2溶液,充分反应后静置后,过滤、洗涤沉淀、干燥、称得沉淀质量为6.99g。
b 方案:称量固体30g,溶于足量稀盐酸中,产生的气体通入含0.1molKMnO4的酸性溶液,反应后再加入0.05mol的H2O2时,KMnO4的溶液恰好褪为无色。
c 方案:称量固体30g,溶于足量稀硫酸中,产生的气体全部被足量的澄清石灰水吸收,完全反应后,石灰水溶液增重6.4g。
粗盐中含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)NaCl既属于_______(填酸、碱或盐),也属于______(填强电解质或弱电解质),该分类方法称为_______,NaCl溶液中共含有________种微粒(包含分子和离子)
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤②中主要涉及的离子反应方程式是____________________________;步骤①和③能否交换顺序_______(填能或不能)。
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是___________。(NA表示阿伏加德罗常数)
| A.粗盐中Na+数目为aNA/58.5 | B.精盐中NaCl物质的量为b/58.5mol |
| C.粗盐中NaCl的质量分数为b/a×100% | D.粗盐中关于NaCl的量无法确定 |
(4)某已滤去泥沙的粗盐经检验不含Na2SO4。该粗盐溶于水配成100mL溶液,加入过量稀NaOH溶液后,过滤得到沉淀Mg(OH)25.8g,滤液中通入CO2,得到如下图(横坐标表示通 入CO2标准状况下的体积,纵坐标表示沉淀的物质的量),回答下列问题:
①b段表示的离子方程式为__________
②100mL溶液中Ca2+的物质的量与所加NaOH的物质的量之比为__________
③P点表示的CO2的体积为__________(标准状况下)。