(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
则: B是____ __溶液(填溶质的化学式,下同),C是______,
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种可能:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:(ⅰ)上述关系一定不正确的是__(填序号)。
(ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为__(填上列四种情况之一的序号);
(ⅲ)若四种离子浓度关系有c(NH4+)=" " c(Cl-),则该溶液一定显__(填“酸性”、“碱性”或“中性”)。
(8分)食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(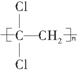 )具有超强阻隔功能,可作为食品保鲜的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔功能,可作为食品保鲜的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。
| A.分子式为C18H34O2 |
| B.一定条件下能与甘油(丙三醇)发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:________________________________________________________________________。
(4)劣质奶粉中蛋白质含量很低,蛋白质水解的最终产物是__________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经完全水解,写出操作步骤、现象和结论:
________________________________________________________________________。
(11分)某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合物
Z(C11H14O2):X+Y浓H2SO4△Z+H2O
(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应,则X是__________(填标号字母)。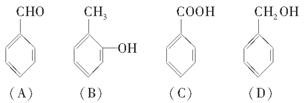
(2)Y的分子式是__________,可能的结构简式是:____________________和____________________。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得F(C4H8O3)。F可发生如下反应:
F浓H2SO4△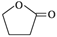 +H2O该反应的类型是__________,E的结构简式是__________。
+H2O该反应的类型是__________,E的结构简式是__________。
(4)若Y与E具有相同的碳链,则Z的结构简式为:__________。
(8分)(2010·浙江卷)最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A,其结构如下:
在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用。为了研究X的结构,将化合物A在一定条件下水解只得到B(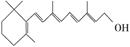 )和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
)和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________。
(3)化合物C能经下列反应得到G(分子式为C8H6O2,分子内含五元环):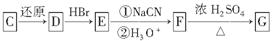
已知:RCOOHRCH2OH,RX①NaCN②H3O+RCOOH
①确认化合物C的结构简式为________。
②F→G反应的化学方程式为______________________________________________。
③化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意三种的结构简式________________________________________________________________________。
(8分)(2011·广东模拟)已知一个碳原子上同时连有两个羟基时,易发生如下转化: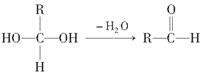
请根据下图回答:
(1)E中含有的官能团的名称是________,③的反应类型是________,C跟新制的氢氧化铜溶液反应的化学方程式为_______________________________________。
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2) ∶n(H2O)=2 ∶1。F是电脑芯片中的高分子光阻剂的主要原料,F的特点是:①能与FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯取代物只有两种。F在一定条件下发生加聚反应的化学方程式为________。
(3)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________种结构,写出其中任意一种同分异构体的结构简式_____________________。
(8分)已知苯酚能跟碳酸钠溶液反应而溶解于碳酸钠溶液中。在下图所示的转化关系中,括号内的编号①~⑤表示某种化学试剂: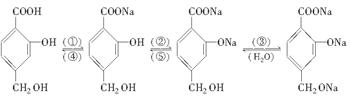
用化学式填空:
①是________,②是________,③是________,④是________,⑤是________。