L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两种含不同化合价的氯元素的物质(每种物质中氮或氯元素的化合价只有一种)。又知物质M中的氮元素化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):
①P+A―→Q+B ②L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途,据此推断在同温同压下,若物质R密度比空气的密度小,则R的化学式为 。
(3)某同学写出下面三个含氮的物质相互转换的关系式:
Ⅰ.M+P―→N2O3+H2O
Ⅱ.N2O4+H2O―→P+Q
Ⅲ.M+L―→Q+H2O
其中一定不可能实现的是 ,理由是 。
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)+ +++H2O
+++H2O
(2)反应物中发生氧化反应的物质,被还原的元素是。
(3)反应中1 mol氧化剂得到mol电子。
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题
(1)沉淀物的化学式分别是:
a;d ;f 。
(2)写出加入试剂A时所发生主要反应的离子方程式
___________________________________________________________________________
(3)写出通入气体B时溶液c中发生反应的离子方程式
__________________________________________
(4) 气体B能否改用试剂A代替?为什么?
______________________________________________________________________
实验室用固体烧碱配制500mL 0.32mol·L-1的NaOH溶液。
①需称量______ ____ g的烧碱固体,固体应放在____________中置于天平左盘称量。
②配制过程中,不需要使用的仪器是(填符号)_____________。
A烧杯 B、量筒 C、玻璃棒 D、1000mL容量瓶 E、漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是_________ (填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是_________:偏高的是______:
A称量时药品和砝码位置颠倒
B称量时间过长
C、溶液未冷却即转入容量瓶
D、容量瓶洗净后未烘干
E、定容时俯视刻度线
F、定容后倒转摇匀,发现液面低于刻度线而未加水补充
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)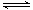 CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,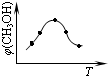
则上述CO2转化为甲醇的反应的△H3__________0(填“>”、“<”或“=”)。
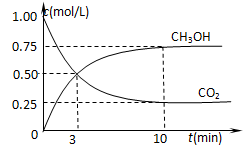
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。试回答:0~10 min内,氢气的平均反应速率为mol/(L·min);该温度下,反应的平衡常数的值为;第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数(填变大、减少、不变)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+) + c(H+)__________c(NO3-) + c(OH-)(填写 “>”“=”或“<”)
A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是______。
(2) 由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为____。
(3) D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为;若有1 mol电子转移,生成Z的物质的量为mol。
(4) 写出实验室制备BA3的化学方程式______________________。将BA3通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式。
(5) 已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池负极反应是_______________。以石墨为电极,用该电池电解100 mL饱和食盐水,一段时间后,在两极共收集到224 mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)________。