在潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可用于制取氧气。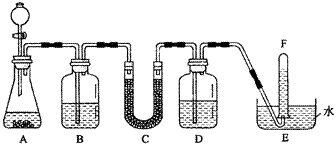
(1)A是用CaCO3制取CO2的装置。写出A中发生反应的化学方程式:
。
(2)按要求填写表中空格:
| 仪器编号 |
盛放的试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
|
与CO2反应,产生O2 |
| D |
|
吸收未反应的CO2气体 |
(3)为了达到实验目的, (填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置;若你认为需要增加一个吸收水蒸气装置,应选用 作为吸水剂;若你认为不需要,请说明理由是 。
(4)证明收集到的气体是氧气的方法是 。
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为 或。
若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
在一个固定容积的密闭容器中,在一定温度下发生下列反应:
A(g)+B(g)→2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为
p mol/L,且C的体积分数为ω。在相同条件下:
(1)若在相同容器中加入2molA和4molB,达平衡后,C的物质的量浓度为_______mol/L;
(2)若在相同容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A______mol,B______mol;
(3)若在相同容 器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是__________________________(其中一个只含a和b,另一个只含a和c)。
器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是__________________________(其中一个只含a和b,另一个只含a和c)。
实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定 。
。
①称取Wg NaOH固体试剂配制成100.00 mL水溶液备用;
②将浓度为c mol/L的标 准盐酸装在用标准盐酸润洗过的25.00 mL酸式滴定管中,调节液面位置
准盐酸装在用标准盐酸润洗过的25.00 mL酸式滴定管中,调节液面位置 在零刻度以下,并记下刻度;
在零刻度以下,并记下刻度;
③取V1 mL NaOH待测溶液置于洁净的锥形瓶中,加入2~3滴甲基橙指示剂充分振荡,然后用浓度为c mol/L的标准盐酸滴定,重复测定3次,平均用去盐酸V2 mL。
试回答:
(1)配制标准盐酸溶液时,必须使用的最主要玻璃仪器是____________。
(2)如有1 mol/L和0.1 mol/L的标准盐酸应选用_____mol/L盐酸,原因是______________
________________________________ _____________________________。
_____________________________。
(3)滴定时,滴定过程中两眼应该注视_____________________。滴定终点时溶液颜色由_____色突变为____色。在盛放待测溶液的锥形瓶下方放一张白纸的作用是。
(4)下列操作会使实验测得结果偏大的是(填选项的序号);
| A.用湿润的pH试纸测定某NaOH溶液的pH |
| B.中和滴定实验中用蒸馏水洗净的锥形瓶直接装待测液 |
| C.若滴定前酸式滴定管尖嘴气泡未排出,滴定结束后气泡消失 |
D.装标准盐酸的 酸式滴定管没有进行润洗 酸式滴定管没有进行润洗 |
E.读数时,若滴定前仰视,滴定后俯视
(5)固体试剂NaOH的质量分数的表达式为。
常温下,将0.01 mol NH4Cl和 0.002 mol NaOH 溶于水配成1 L混合溶液,
!)该溶液中存在的三个平衡体系是:______________________________、
_______________________________、_______________________________。
溶液中共有_______种不同的粒子。
这些粒子中浓度为0.01 mol/L 的是_________,浓度为0.002 mol/L 的是_________。
(4)物质的量之和为0.01 mol的两种粒子是:___________和______________。
(5)_______和_______ 两种离子数量之和比OH-多0.008mol。
下列是酸溶液与碱溶液发生反应的各种关系,请用“>”“<”或“=”填空:
(1) 取0.2 mol/LHX溶液与0.2 mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(X-)。
①混合溶液中c(HX) c(X-);
②混合溶液中c(HX) + c(X-) 0.1 mol/L(忽略溶液体积变化);
③混合溶液中由水电离出的c(OH-) 0.1 mol/L 的HX溶液中由水电离出的c(H+)。
(2) 如果取0.2 mol/LHX溶液与0.1 mol/LNaOH溶液等体积混合,测得混合溶液的PH>7,则说明在相同浓度时HX的电离程度 NaX的水解程度。
(3) 分别取pH=2的硫酸和醋酸各50mL,加入足量的镁粉,反应开始时,反应速率前者_________后者;充分反应后,相同条件下产生氢气的体积前者_________后者。
(4) 等浓度等体积的盐酸和醋酸,分别与等浓度的NaOH溶液反应,恰好中和时,消耗NaOH的体积前者__________后者,所得溶液的pH前者________后者。