在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题: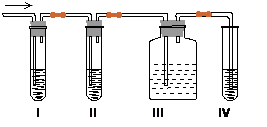
(1)I、II、III、IV装置可盛放的试剂是
I ;II ;III ;IV (将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是 。
(3)使用装置II的目的是 。
(4)使用装置III的目的是 。
(5)确定含有乙烯的现象是 。
在反应3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O中:
(1)_________元素化合价升高,_________元素化合价降低。(填元素名称)
(2)_________是氧化剂,Cu发生了_________反应,_________是氧化产物
(3)用双线桥法表示该反应电子得失的方向和数目:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
在3个温度、容积相同的1 L密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得一分钟后反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molN2、3molH2 |
2molNH3 |
4molNH3 |
| NH3的浓度(mol•L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
a1=25% |
α2 |
α3 |
(1)由以上数据,甲、乙、丙达平衡时, N2的浓度大小关系为__________________,从反应开始到达到平衡,甲中以H2表示的反应速率是__________。
(2)该温度下,丙中反应2NH3 N2+3H2的平衡常数是__________。
N2+3H2的平衡常数是__________。
(3)a+b______92.4(填“<”、“>”或“=”,下同);α1+α3______1。
(4)若要使甲重新达平衡后c(NH3)/c(N2)比值变小,其他条件可采用________。
A.使用催化剂
B.增大氮气浓度
C.升高温度
D.缩小容器体积
在20 L的恒容密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06 mol/L,反应至8 min时达平衡状态。
(1)在0~4 min内生成O2的平均速率v(O2)=___ mol/(L·min)。
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=______。
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是______,此时的平衡常数与(2)中相比________(填“增大”、“减小”或“不变”)。
| 选项 |
A |
B |
C |
D |
| SO3 |
1 mol |
3 mol |
3 mol |
0 mol |
| SO2 |
2 mol |
1.5 mol |
0 mol |
6 mol |
| O2 |
2 mol |
1 mol |
0 mol |
5 mol |
反应aA(g)+bB(g)  cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为 a∶b。则
cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为 a∶b。则
(1)平衡时A与B的转化率之比是__________。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b)______(c+d)(填“>”、“=”、“<”或“没关系”)。
(3)设定a=2 ,b=1,c=3,d=2,在甲、乙、丙、丁4个相同的容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是______(填容器序号,下同) 。
t℃时,将3molA和2molB气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气)  xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)________α(B)(填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C)都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入__________(填A或B)________mol(用a表示),